Brustabletter reaktion
Hej,
Jag gör en laboration där jag löser C-vitamin brustabletter i vatten och fick fram detta reaktionsförlopp, men jag förstår inte varför man behöver lösa upp ämnena i vatten först. Varför reagerar inte bara natriumvätekarbonatet och citronsyran utan närvaro av vatten?
wil1 skrev:Hej,
Jag gör en laboration där jag löser C-vitamin brustabletter i vatten och fick fram detta reaktionsförlopp, men jag förstår inte varför man behöver lösa upp ämnena i vatten först. Varför reagerar inte bara natriumvätekarbonatet och citronsyran utan närvaro av vatten?
För att det inte är (bara) de reaktioner som står skrivna som sker.
De reaktioner som spelar roll är
HCO3-(aq) + H3O+(aq) <=> H2CO3(aq) + H2O
H2CO3(aq) <=> CO2(g) + H2O
Dessa reaktioner syns knappast bland alla onödiga åskådarjoner som finns med i dina reaktionsformler. Att det är nödvändigt att jonerna är i vattenlösning syns inte i din summaformel. När syran och vätekarbonatet är i fast form kan inte jonerna röra sig, och kommer alltså inte åt att reagera med varandra.
Okej, tack för hjälpen. Är det således alls nödvänligt att ha med åskådarjonerna när man beskriver händelseförloppet, givet att man ska beskriva hur brustabletterna "löses" upp i vatten och bildar koldioxid?
Jag tycker inte det, men det är bäst att du kollar vad din lärare tycker.
Tack. En fråga generellt hur c-vitamin brustabletter fungerar: de innehåller ju akosrbinsyra (vitamin c), citronsyra och natriumvätekarbonat.
Är det så att citronsyrat och natriumvätekarbonatet reagerar för att bilda askorbinsyra då?
Nej. Askorbinsyra och citronsyra är två olika syror. Askorbinsyra (överst) är en syra, men inte en karboxylsyra. Citronsyra innehller 3 stycken karboxylgrupper och är alltså en trevärd karboxylsyra.

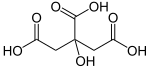
Okej så askorbinsyra är en syra, medan citronsyra är en trevärd karboxylsyra.
Men vad är ens tanken med en c-vitamin brustablett och varför har man då citronsyra om man ändå vill åt askorbinsyran? är det något jag missar reaktionsmässigt
För att det skall bubbla, och för att det nte skall bli för dyrt. Troligen för smakens skull också.
Är det inte vätekarbonatet som reagerar med vatten som gör att det bubblar? (dvs koldioxden).
Det behövs en syra för att det skall brusa ordentligt. Bara natriumvätekarbonat i vatten ger inte bubblor.
wil1 skrev:Okej så askorbinsyra är en syra, medan citronsyra är en trevärd karboxylsyra.
Men vad är ens tanken med en c-vitamin brustablett och varför har man då citronsyra om man ändå vill åt askorbinsyran? är det något jag missar reaktionsmässigt
Lite vid sidan av ämnet, men eftersom du frågar (och jag är i branschen).
Brustabletter är en av de beredningsformer som läkemedel kommer i. Andra vanliga beredningsformer är tabletter, spray (som nässpray) och droppar (som ögondroppar).
En fördel med brustabletter är att de verkar snabbare, eftersom de redan är upplösta när de hamnar i magen. För C-vitamin spelar det väl ingen roll, men för Alvedon kan det vara värdefullt.
En annan positiv sak är att det är mindre risk för överdosering. Det är lättare att ta för många tabletter av misstag än att dricka för många glas av din bubblande medicin. Det är därför du kan köpa Alvedon brus på ICA, men inte Alvedon tablett.
Vissa personer har också svårt att svälja tabletter och då kan brustabletter vara ett alternativ.
Jag har själv smakat ren askorbinsyra (i pulverform) och det är fruktansvärt surt. Det går inte att jämföra med de suraste citroner du kan hitta. Det är inte så dumt med en vattenlösning.
Okej, tack för informationen från båda er två. Det uppskattas. Jag har också funderat hur reaktionshastigheten ändrar sig huruvida man har vatten jämfört med kolsyrat vatten (H2CO3(aq)).
För att konstatera är hela reaktionen med brustabletten en syra-bas reaktion där oxoniumjonen agerar som bas och vätekarbonatet som syra.
Givet att man löser denna brustablett i kolsyrat vatten, så borde reaktionstiden vara längre eftersom H2CO3 är mycket mer? Vi får alltså samma reaktionsförlopp, se nedan, men att kolsyrat bara är mer (tänk att stoppkriteriet för tiden är när brustabletten är helt upplöst, inte när det slutar bubbla). Är detta ett korrekt resonemang? Eller finns det några andra resonemang?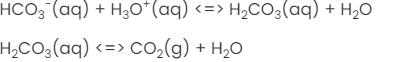
wil1 skrev:...
För att konstatera är hela reaktionen med brustabletten en syra-bas reaktion där oxoniumjonen agerar som bas och vätekarbonatet som syra.
Nej, tvärtom! Oxoniumjonen är en syra (den avger en vätejon) och vätekrbonatet är en bas (tar upp en vätejon).
Smaragdalena skrev:wil1 skrev:...
För att konstatera är hela reaktionen med brustabletten en syra-bas reaktion där oxoniumjonen agerar som bas och vätekarbonatet som syra.
Nej, tvärtom! Oxoniumjonen är en syra (den avger en vätejon) och vätekrbonatet är en bas (tar upp en vätejon).
Ja visst är det så! Tack för påpekandet, blandade ihop det. Hur skulle du beskriva resonemanget ovan med det kolsyrade vattnet?




