Buffer
Hej!
The pH of a phosphate buffer is 6,50. Calculate the ratio of the concentration of the acid to that of the conjugate base. pKa(H2PO-4)=7,20 at 25 degrees Celsius.
Svaret som jag fick är 0,20, då jag gjorde subtraktion först mellan pH och pKa och därefter 10 upphöjt till det värdet som jag fick vid subtraktion, för att få bort logaritmen. Men det är fel svar.
Hur får man rätt svar, som då är 5,01?
Uträkning är nedan.
Tack så mycket!
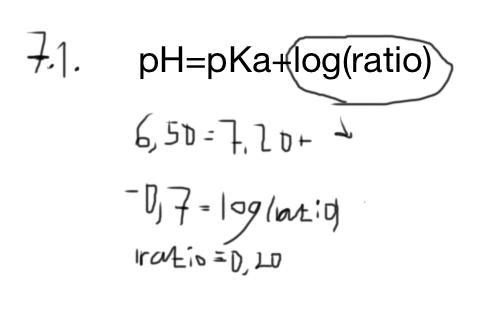
Tråd flyttad från Natur och teknik/Kemi/Högskola till Natur och teknik/Kemi/Kemi 2. /Smutstvätt, moderator.
Du har räknat ut koncentrationsförhållandet bas/syra. Det frågas efter syra/bas.
Hur räknar man ut det då?
Ska man istället göra det jag gjorde fast som pOH=pKb+log(ratio)
Så kan man lösa ut ratio utifrån den, acid/conjugate base står det, skulle du kunna visa med uträkningar isåfall bara lite hur det skulle se ut för att komma till rätt svar.
Tack så mycket!
Det finns två sätt att skriva buffertformeln i sur miljö: eller . Du har använt något mellanting.


