Buffert och Syrabas-jämvikt
En buffert tillverkas genom att man löser 0,020 mol myrsyra, HCOOH, och
0,012 mol av dess natriumsalt i vatten och späder med ytterligare vatten till
slutvolymen 2,0 dm3
Myrsyrans pKa är 3,78. pKw=14,00.
Observera! Alla initialkoncentrationerna är beräknade men beräkningarna var för triviala för att vara med.
a) Beräkna pH i lösningen.
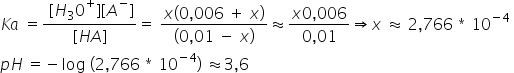
Svar: 3,6 (korrekt)
b) Därefter tillsattes 2,00 g NaOH med försumbar volymförändring.
Beräkna lösningens pH efter tillsatsen av NaOH..jpg?width=800&upscale=false)
Syrabas-jämvikt:.jpg?width=800&upscale=false)
.jpg?width=800&upscale=false)
Här blir koncentrationerna negativa Fel beräkningar?
När jag istället stället upp en syrabas-jämvikt med konjugatbasen erhålls:
Svar: ph =12,2 (korrekt)
Varför blir det rätt nu? är inte båda syrabas-jämvikterna ekvivalenta då de händer simultant i lösningen? varför blir det då fel med första syrabasjämvikten?
Du tillsatte mer NaOH än vad det fanns myrsyra. All myrsyran har förbrukats. Lösningen är basisk. Som du märkte, behöver man räkna med Kb istället. Ka (där koncentrationen för oxoniumjoner ingår) använder man i sura lösningar. Kb (där koncentrationen för hydroxidjoner ingår) använder man i basiska lösningar.
smaragdalena skrev :Du tillsatte mer NaOH än vad det fanns myrsyra. All myrsyran har förbrukats. Lösningen är basisk. Som du märkte, behöver man räkna med Kb istället. Ka (där koncentrationen för oxoniumjoner ingår) använder man i sura lösningar. Kb (där koncentrationen för hydroxidjoner ingår) använder man i basiska lösningar.
1. Hur vet jag att lösningen är mer basisk än sur? Vi hade ju kvar oxoniumjoner sen innan och det är väl detta som definierar SUR lösning? Eller är det för att koncentrationen är betydligt högre för hydroxidjonerna? 0,015M jämfört med en tiotusendel.
2. Men jag skulle väl ändå kunna använda mig av Ka? Kb = Kw/Ka och således skulle jag kunna räkna på en sur lösning för att sedan använda mig av senaste sambandet för att ta reda på kB.
Du har tillsatt jättemycket hydroxidjoner jämfört med syran som fanns.
I en sur lösning finns det fler oxoniumjoner än det finns hydroxidjoner, i en basisk lösning är det tvärtom. Det finns alltid av båda sorterna, men det kan vara extremt lite av den andra. Om du t ex har en sur lösning med pH = 4, är koncentrationen av oxoniumjoner en miljon ggr högre än koncentrationen av hydroxidjoner. Vid pH = 1 är det en biljon ggr. Det går säkert att räkna på alla möjliga krångliga sätt, men varför göra det svårt för sig när det inte behövs?
smaragdalena skrev :Du har tillsatt jättemycket hydroxidjoner jämfört med syran som fanns.
I en sur lösning finns det fler oxoniumjoner än det finns hydroxidjoner, i en basisk lösning är det tvärtom. Det finns alltid av båda sorterna, men det kan vara extremt lite av den andra. Om du t ex har en sur lösning med pH = 4, är koncentrationen av oxoniumjoner en miljon ggr högre än koncentrationen av hydroxidjoner. Vid pH = 1 är det en biljon ggr. Det går säkert att räkna på alla möjliga krångliga sätt, men varför göra det svårt för sig när det inte behövs?
Jag håller med men finns det överhuvudtaget fel i mina beräkningar när jag räknar på Ka? I och med att man handskas med så många decimaler är det givet att nåt blir fel känns det som.
Om du har kommit fram till att all syra är förbrukad (vilket den är när man har tillsatt så mycket bas, hade det varit en titrering skulle man ha varit förbi ekvivalenspunkten), och koncentrationen av myrsyra alltså är 0, så försöker du dividera med 0, och det går inte.
smaragdalena skrev :Om du har kommit fram till att all syra är förbrukad (vilket den är när man har tillsatt så mycket bas, hade det varit en titrering skulle man ha varit förbi ekvivalenspunkten), och koncentrationen av myrsyra alltså är 0, så försöker du dividera med 0, och det går inte.
Är det inte x som jag dividerar med? För vid syrabas-jämvikten måste lite syra skapas väl?
Det blir i alla fall tokigt när du inte har med hydroxidjonerna. Vad fick du fram för koncentration för myrsyran när du räknade med Kb?
smaragdalena skrev :Det blir i alla fall tokigt när du inte har med hydroxidjonerna. Vad fick du fram för koncentration för myrsyran när du räknade med Kb?
Ber om ursäkt. Sista uttrycket ska vara Kb, inte Ka. Alltså: 1,77* 10^-4


