Cellschema
Hej, jag fattar inte riktigt b-uppgiften alls här. Som jag löser den, så skriver jag upp reaktionen med oxidationstal och tittar på vad som oxideras respektive reduceras. Och tar bara med dom i cellschemat som ni kan se i min lösning. Men som ni ser i den understa bilden så är det på ett annat sätt enligt facit. Är min lösning helt fel, och vad har jag isåfall missuppfattat?

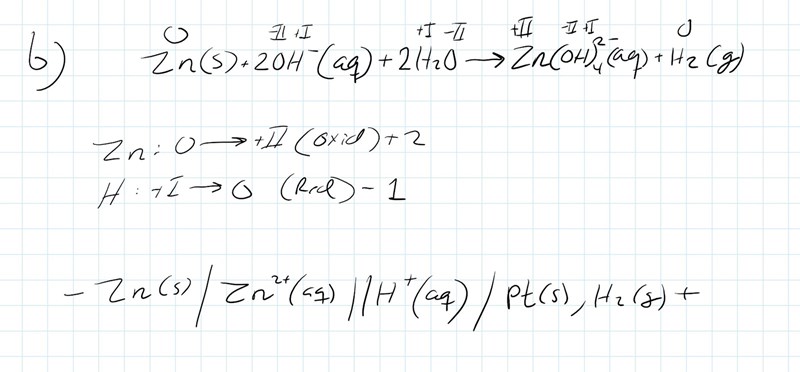
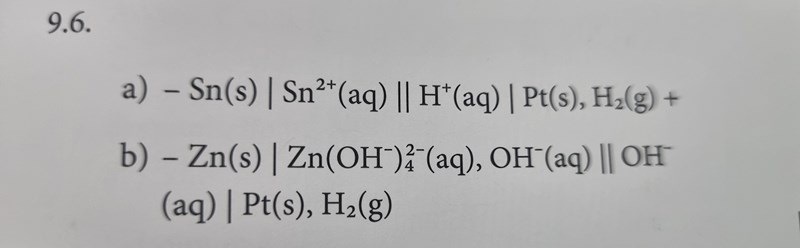
Egentligen har både du och facit rätt, trots att ni har svarat olika. Jag ska försöka förklara varför, men det kräver lite kunskaper från kemi 2 och en gnutta universitetskemi. Jag kallar facits metod för "Alternativ 1" och din metod för "Alternativ 2".
På sätt och vis är facits lösning mer korrekt, eftersom elektrolyten domineras av tetrahydroxozinkatjoner och inte fria zinkjoner. På samma sätt kan man utifrån totalreaktionen i uppgiftstexten misstänka att reaktionen sker i basiskt pH, vilket då gör det mer rimligt att ha hydroxidjoner snarare än vätejoner som reaktanter. Men om man räknar på detta så ser man att man kommer fram till samma cellpotential både med din och facits totalreaktion/cellschema.
Om man räknar med standardtillstånd för facits reaktion, dvs att vätgasen har trycket 1 bar och alla koncentrationer är 1 mol/dm3 så kommer man fram till cellpotentialen 0,37 V. Om man räknar på samma sätt med din reaktion får man istället en cellpotential på 0,76 V. Men om man har förutsatt standardtillstånd för facits reaktion kan man inte göra det för din reaktion. T.ex. kan inte koncentrationen av vätejoner vara 1 mol/dm3 om man redan har sagt att koncentrationen av hydroxidjoner är 1 mol/dm3. Produkten av dessa koncentrationer måste ju motsvara Kw dvs 10-14 (mol/dm3)2. På motsvarande sätt kan inte koncentrationen av zinkjoner vara 1 mol/dm3 om man har definierat koncentrationen av tetrahydroxozinkatjoner som 1 mol/dm3 eftersom det finns en kemisk jämvikt som styr förhållandet mellan dessa två koncentrationer.
Man kan istället räkna ut vad koncentrationerna av alla ämnen i ditt cellschema "måste vara", och gör man det så inser man att cellpotentialen blir lika hög för din reaktion som för facits reaktion (0,37 V).




