ClF3. Molekylstruktur
Hej, jag har en fråga angående molekylstrukturen för ClF3. Jag undrar varför den blir T-shaped och inte Trigonal plan.
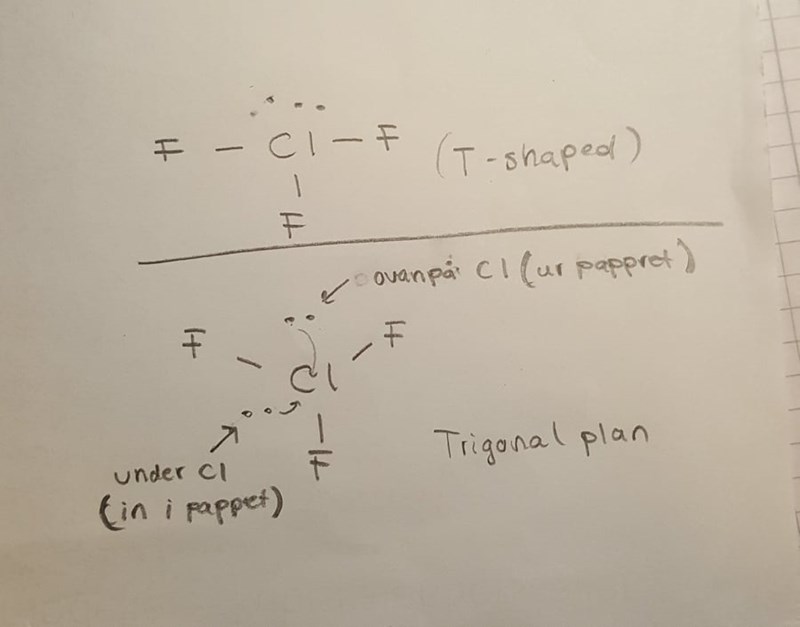
Cl har två fria elektronpar och jag undrar varför den ena inte kan vara under och den andra vara ovanför Cl. Blir inte repulsionen mellan dessa två elektronparen mindre om man ritar upp Lewisstrukturen som jag gjort under?
Välkommen till Pluggakuten!
Fem elektronpar ordnar sig som en trigonal bipyramid. Icke-bindande elektronpar repellerar varandra mer än bindande elektronpar, så de två icke-bindande elektronparen placerar sig i det trigonala planet. De tre bindande elektronparen hamnar i de tre lediga posititionerna, d v s molekylen blir T-formad.
Hänger inte riktigt med nu. Om icke-bindande elektronpar repellerar varandra mer än bindande elektronpar vill de då inte bort från varandra så långt som det går? Alltså att den ena ligger under och andra ligger ovanför Cl.
Eftersom om vi tar en annan exempel XeF4, denna molekylen är ''square planar'', alltså att den ena icke-bindande elektronpar ligger under och den andra ligger ovan. Då kommer repulsionskraften vara som minst mellan dessa två icke-bindande elektronpar. Varför gäller inte sammasak för ClF3?
Dels finns det tre elektronpar som ligger i samma plan och bildar en triangel. Det är 120 grader mellan de riktningarna. Dels finns det två elektronpar som är vinkelräta mot detta plan. Vinkeln mellan ett sådant elektronpar och vart och ett av de trigonala elektronparen är 90 grader, d v s mindre än 120 grader.


