Coulombs lag - Avstånd mellan elektroner och protoner
Hej,
Coulombs lag:
Avståndet mellan två elektriska laddningar, ena positiv och andra negativ, Q1 respektive Q2 har konstant avståndet r mellan varandra.
Kraften mellan är en attraherande kraft eftersom motsatta laddningar. Ändå förblir avståndet r konstant. Vad är det som gör att avståndet r hålls konstant. Elektronen rör sig fort runt atomkärnan/protonen.
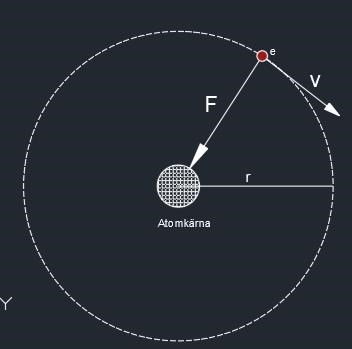
Så den konstanta hastigheten gör att avståndet r förblir densamma. Och det som gör att elektronen inte flyger i väg så lätt är den attraherande kraften? (Detta leder till annan fråga, hur kan detta ske, vart kommer energin ifrån för att elektronen skall ha konstant hastighet runt kärnan? (får ta det någon annan gång :))
Känns att jag besvarade min fråga när jag fick tänka till hur jag skulle formulera frågan och rita en figur till det :) Får klura lite på den överstrukna frågan.
**
Men om hastigheten gör att avståndet "r" förblir densamma så kommer jag att tänka på: https://www.pluggakuten.se/trad/adelgasstruktur-jon/?order=all#post-ce37c8d8-0d8d-4524-a1d2-aadd01711876
Teraeagle: Varje väteatom har en elektron som befinner sig i atomorbitalen 1s. Vätes elektronkonfiguration är alltså 1s1. Elektronens rörelser beskrivs av en vågfunktion och schrödingerekvationen anger inom vilka områden elektronen är stabil, med andra ord var det är mest sannolikt att hitta elektronen. Det är detta område som kallas för orbital.
*Om det nu är hastigheten som gör att avståndet förblir konstant, hör schrödingerekvationen ihop med centripetalkraften på något sätt?
Om avståndet mellan elektron och kärna är , så måste ju området/orbitalen man lär hittar en elektron i detta fallet ligga på [m]? Därför tänker jag att schrödingerekvationen och centripetalkraften/coulombs lag möjligen hör ihop på något sätt? Det tycks båda ge en fingervisning om elektronens position.
---
AHHH stort huvudbry... frågorna blir bara fler och fler ju fler man besvarar. Och inte är jag tydlig/kunnig nog att ställa rätt frågor.
Sammanfattning
Tror i alla fall att jag besvarat på huvudfrågan:
Avståndet mellan två elektriska laddningar, ena positiv och andra negativ, Q1 respektive Q2 har konstant avståndet r mellan varandra på grund av hastigheten elektronen har. Den hålls i banan/sitt område med hjälp av centripetalkraften från den attraherande kraften mellan de två olika laddade laddningarna.
Men hur och i fall schrödingerekvationen och centripetalkraften hör ihop har jag inte besvarat. Lika så hur elektronen ens får sin hastighet runt kärnan och vad gör att den kan förbli konstant. Får nog öppna en kemibok också.
Sidofråga (eventuellt enkel/lite dum): om man trycker in något mellan atomkärna och elektron upphör den attraherande kraften? Kan man på så vis separera alla elektroner från atomkärnan?
Det finns tyvärr ett lite grövre misstag i denna diskussion, och det är att enstaka (eller par av) elektroner ej kan behandlas med klassisk mekanik eller klassisk elektrodynamik. Du har helt rätt i din observation att det är hastigheten, eller rättare sagt, rörelsemängdsmomentet som håller två klassiska laddade kulor i en roterande bana, trots att kraften är attraherande. Det fungerar precis lika med planeter som snurrar i bana runt solen, eller satelliter som snurrar bana runt jorden. (Tänk lite på detta och se om du kan förstå likheten)
När det kommer till kvantmekanik och Schrödingerekvationen så måste du lägga (nästan) all klassisk intuitiv fysik åt sidan, det är det som gör kvantfysik så jobbigt för många. Enstaka elektroner har inga specifika positioner och det finns inget specifikt avstånd mellan elektroner och atomkärnan. Kvantmekanik är i grunden statistisk och lösningen till Schrödingerekvationen ger en sannolikhetsfördelning för systemets (t ex en väteatom) tillståndsvariabler. Att tänka på en väteatom som en elektriskt laddad elektron som på något sätt "snurrar" runt en atomkärna är alltså rent av inkorrekt, och därmed blir det inte meningsfullt att försöka relatera centripetalkrafter till orbitaler.
Förövrigt så kommer ordet orbital från det väldigt tidiga stadiet av kvantfysiken, när man fortfarande föreställde sig atomer som klassiska system. Man trodde i princip att atomer var som små solsystem och att elektronerna befann sig i "banor" (orbits) runt kärnan. Kvantmekaniken har utvecklats sedan dess, men ofta hänger namnen kvar.
Ok, jag förstår. Fått en skjuts i rätt riktning och fler områden att kika vidare på. Hade lite på känn att den klassiska mekaniken/elektrodynamiken inte riktigt fungerade här.
Tack :)
Ett av problemen med planetmodellen är att elektronen borde sända ut strålning eftersom den är en laddning som rör sig.


.jpg?width=80&crop=0,0,80,80)

