E2 elller SN2?
När man blandar koncentrerad ammoniak med 1-klorobutan bildas först wå vätskeskikt' Efter en tids kraftig omröring försvinner den ena fasen så att en klar lösning uppstår. Skriv en reaktionsformel och förklara vilken reaktion som skett och vilka produkter som bildats?
Hur skall man tänka, jag tänker personligen eftersom basen är sterisk hindrar kommer det ske en E2 reaktion, men det är fel enligt facit? Vart ätnker jag fel?
Vad är den ursprungliga frågan? Har du ett överskott av ammoniak? Vad är lösningsmedlet?
Du vet att ditt substrat är primärt och att din nukleofil har ett delokaliserat elektronpar som kan vara med i en nukleofil attack. När du tänker att det borde bli en E2 reaktion så kräver det att ammoniak ska agera bas och ta ett väte från ditt substrat - men du får komma ihåg att ammoniak är en ganska svag bas. Det finns en större drivkraft att attackera kolet som klor är bundet till.
Pikkart skrev:Vad är den ursprungliga frågan? Har du ett överskott av ammoniak? Vad är lösningsmedlet?
Du vet att ditt substrat är primärt och att din nukleofil har ett delokaliserat elektronpar som kan vara med i en nukleofil attack. När du tänker att det borde bli en E2 reaktion så kräver det att ammoniak ska agera bas och ta ett väte från ditt substrat - men du får komma ihåg att ammoniak är en ganska svag bas. Det finns en större drivkraft att attackera kolet som klor är bundet till.
Detta är ursprungs frågan, så det du försöker få fram är att en sn2 reaktion sker istället. Men hur bildas butylammoniumklorid? enligt facit, jag tänker att SN2 resulterar till att amoniak bara hoppar in och tar Cls plats.
Kom ihåg att det är en polariserad bindning mellan kloret och kolet, ammoniak kan attackera där - och klor lämnar. Om du har flera molekvivalenter så kan även ammoniak deprotonera ett väte.
Pikkart skrev:Kom ihåg att det är en polariserad bindning mellan kloret och kolet, ammoniak kan attackera där - och klor lämnar. Om du har flera molekvivalenter så kan även ammoniak deprotonera ett väte.
vänta, två saker jag inte förstår, vad menas med moekvivalenter och varför blir namgivningen butylammoniumklorid?
Om du har använder 2 mol ammoniak till 1 mol 1-klorobutan så har du två molekvivalenter - benämning man använder inom kemin. Det här är ingenting du behöver i din uppgift då du har 1:1, ritar du upp den nukleofila attacken så ser du att din produkt blir just butylammoniumklorid.
För att riktigt hajja reaktionsmekanismer, rita upp molekylerna och kolla vilka utfall du kan få med regler för SN1,SN2,E1 och E2.
Nja, när jag ritar så gör NH3 en nukleofil attack och tar då platsen av Cl. Det bildas 1-Amoniakbutan. Eftersom det är en primär haloalken som reagerar med en relativt svag bas, detta ger en SN2 reaktion. När jag ritar den så lämnar Cl och NH3 tar dess plats.
OlafJohansson21 skrev:Nja, när jag ritar så gör NH3 en nukleofil attack och tar då platsen av Cl. Det bildas 1-Amoniakbutan. Eftersom det är en primär haloalken som reagerar med en relativt svag bas, detta ger en SN2 reaktion. När jag ritar den så lämnar Cl och NH3 tar dess plats.
Du verkar slarva med laddningarna.
Smaragdalena skrev:OlafJohansson21 skrev:Nja, när jag ritar så gör NH3 en nukleofil attack och tar då platsen av Cl. Det bildas 1-Amoniakbutan. Eftersom det är en primär haloalken som reagerar med en relativt svag bas, detta ger en SN2 reaktion. När jag ritar den så lämnar Cl och NH3 tar dess plats.
Du verkar slarva med laddningarna.
vad menar du? Cl-?
Om en kloridjon lämnar samtidigt som molekylen binder till en ammoniakmolekyl, måste det bli en positivt laddad jon.
Nu förstår jag verkligen inte vad som händer.
Det lättaste när det kommer till uppgifter i organisk kemi är att alltid bifoga en bild, det är lätt att en fråga ställs fel utifrån vad man de facto har.
Rita upp strukturen för när ammoniak har attackerat kolet, ser du några laddningar i molekylen ?
ni får föreställa er vätet. 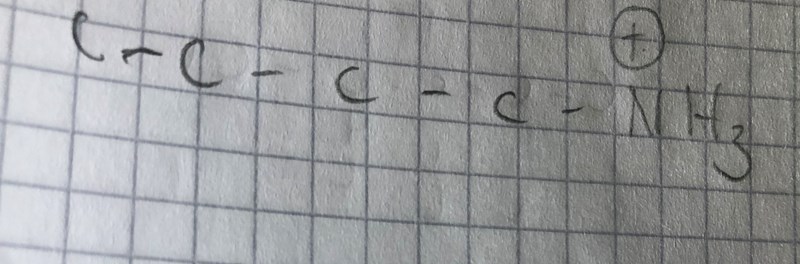
Tror du inte att den negativt laddade jonen söker sig till den positiva laddningen?
Pikkart skrev:Tror du inte att den negativt laddade jonen söker sig till den positiva laddningen?
jo, men hur fungerar namngivningen?
Du har ju skrivit där uppe att strukturformeln blir butylammoniumklorid - du får det förklarat varför den strukturen uppstår.
Kan du hänvisa mig till förklaringen, jag förstår inte vad du syftar till. Att ammoniak kan deprotoneras?
Jag känner att du slår knut lite på frågeställningen. Först säger du att produkten blir butylammoniumklorid och sen inte?
När något deprotoneras så förlorar det ett väte, ett kol kan inte deprotoneras per se men ett väte som är bundet till ett kol kan.
Ammoniak är en bas så min tolkning av reaktionsmeknismen är att en andra molekvivalent skulle deprotonera ett väte från kvävet och slå upp en dubbelbindning mellan kvävet och kolet.
Men jag vet inte vad som gäller, jagbjag ganska förvirrad av tråden.




