Elektrolys av smält natriumklorid (+ Aluminiumoxid)
Hejsan!
Jag har inte riktigt förstått elektrolys av smält natriumklorid
Det finns inte riktigt en bild på hur det går till, så jag ritade min egen. Dock är detta inte samma elektrolys. Jag bara undrar om det är samma princip eller om jag verkligen säger rätt mig själv.
Smält elektrolys av aluminium: (tog detta från filmen)
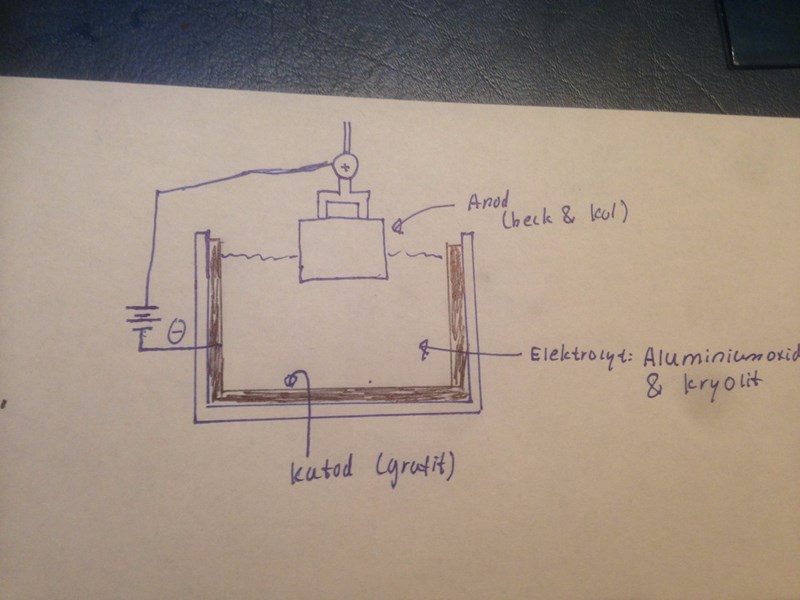 I den anoden sker följande:
I den anoden sker följande:
^ det skall föreställa ett O
Okej, jag förstår inte riktigt vad som menas med detta. Är det blandningen av beck och kol som oxiderar? Vad är 2O^2? *edit* Vad händer därefter? Med dem andra reaktionerna med kol och 2O.
Vid katoden sker detta:
Här reduceras det. Al reagerar med elektronerna från anoden. Men jag förstår inte riktigt varför det händer. Hur spelar Aluminiumoxid in i denna reaktion? Borde det inte vara grafit?
Vad jag förstår är att Aluminiumoxid blandas med kryolit som en elektrolyt. Men varför är den med i reaktion i anoden?
Sedan kommer också "total reaktionen":
Allt känns flummigt och jag tror jag har det allt fel :(
Tack på förhand!
Jag är inte lärare, men elektrolys av den här typen ligger nog på åtminstone gymnasienivå. Om jag minns rätt är dessutom just elektrolys för produktion av aluminium rätt dåligt förstådd. Ibland vet man bara att något fungerar, men inte den exakta kemin bakom.
När aluminiumoxid smälts, får man fria oxidjoner (syrejoner) och aluminiumjoner. De förstnämnda dras till anoden, reagerar med grafiten och bildar koldioxid. Aluminiumjonerna bildar smält aluminium vid katoden. Kryoliten används för att sänka smältpunkten hos aluminiumoxid, vilken annars är alldeles för hög för att man ska kunna smälta det. På svenska brukar vi kalla ämnen med denna funktion för ”flussmedel”.
Teraeagle skrev :Jag är inte lärare, men elektrolys av den här typen ligger nog på åtminstone gymnasienivå. Om jag minns rätt är dessutom just elektrolys för produktion av aluminium rätt dåligt förstådd. Ibland vet man bara att något fungerar, men inte den exakta kemin bakom.
När aluminiumoxid smälts, får man fria oxidjoner (syrejoner) och aluminiumjoner. De förstnämnda dras till anoden, reagerar med grafiten och bildar koldioxid. Aluminiumjonerna bildar smält aluminium vid katoden. Kryoliten används för att sänka smältpunkten hos aluminiumoxid, vilken annars är alldeles för hög för att man ska kunna smälta det. På svenska brukar vi kalla ämnen med denna funktion för ”flussmedel”.
Är inte anoden gjord av beck och kol? Som visas på min bild.
Tänkte att detta var överkurs för mig i 9:an, men nu när jag har gått in i det kan jag inte bara lämna det.
Vad vill dem ha sagt med total reaktionen?
Hur reaktionen ut mellan oxidjonerna med det?
Reaktionen vid anoden enligt en film:
2O2 →02 + 4e^− C(c) + 20(2neråt)(g)→CO2 (g)
?
Den är gjord av allt möjligt som innehåller höga kolhalter. En vanlig typ kallas för ”Söderbergelektrod” och den tillverkar man kontinuerligt vid elektrolysen. Man sätter en pasta med kol, beck, grafit, you name it och lösningsmedel högst upp på elektroden. Allt eftersom reaktionen sker äts elektroden upp och den måste tryckas neråt i smältan. När temperaturen då blir högre kommer pastan att ”bakas” till en stelnad massa.
Om jag skall gå igenom allt igen:
När aluminiumoxid smälts bildas fria oxidjoner och aluminiumjoner. Oxidjoner reagerar med anoden (kol, beck t.ex.) och aluminiumjonerna smälts vid katoden.
Sker det någon reaktion vid katoden?
Det jag skriv, som jag följde efter en film. Säger att aluminiumoxid reagerar med 3 elektroner.
Aluminiumjonerna plockar upp elektroner vid katoden och bildar aluminium(atomer). Eftersom temperaturen är så pass hög kommer bildat aluminium att vara flytande.
Skrev fel, menade aluminiumjon. Inte aluminiumoxid.
Aluminiumoxiden smälts och det bildas oxidjoner och aluminiumjoner. Oxidjonerna reagerar med anoden och det sker en oxidation? Oxidjoner blir syre och några elektroner. Dessa elektroner förs senare vidare till katoden där elektronerna reagerar med aluminiumjonerna (det reducerar) Vilket menas att det blir till atomer.
Stämmer det? På ett snabbförklarat sätt
Oxidjonerna reagerar vid och med anoden under bildning av koldioxid. Annars är det rätt.
Teraeagle skrev :Oxidjonerna reagerar vid och med anoden under bildning av koldioxid. Annars är det rätt.
Tack så mycket för hjälpen! Förstår äntligen.
Är detta ungefär samma princip för elektrolys av smält natriumklorid?
Ja, det är samma grundläggande princip.
Teraeagle skrev :Ja, det är samma grundläggande princip.
Tack igen! Väldigt intressant.



