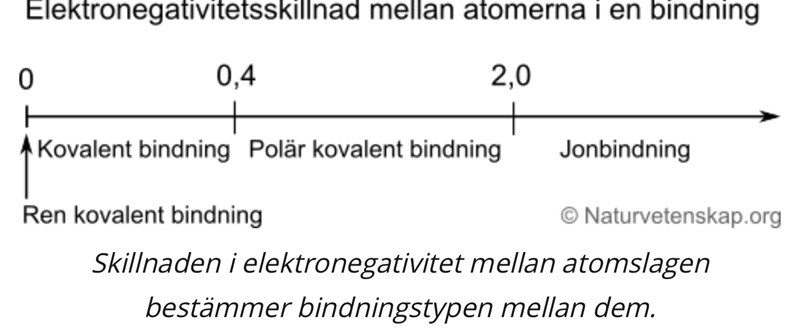
Elektronegativitets skillnad
 Jag hade till uppgift att ta reda på ifall svavelväte var en dipol eller inte. Och vilka intermolekylära bindningar som håller ihop svavelväte molekylerna
Jag hade till uppgift att ta reda på ifall svavelväte var en dipol eller inte. Och vilka intermolekylära bindningar som håller ihop svavelväte molekylerna
1) Det första jag gör är att kolla på elektronegativitets tabellen. Svavel : 2,5 . Väte : 2,1.
skillnaden i elektronegativitet= 0,4 -> kovalent bindning enligt tallinjen ovan.
2) jag drar slutsatsen att molekylen är opolär (0,4 i elektonegativitet) och att det därmed finns van deer waals bindning i mellan. Men! Det är förstås fel! Svavelväte är en dipol. Men hur kan det vara en dipol?
Om vi jämför med metan (en kolväte)
Skillnad mellan C och H i elektronegativitets värdet är också 0,4, det är van der waals bindning i mellan metan molekylerna.Kolvätet metan räknas som opolär och är inte en dipol.
Varför är det fel att göra på samma sätt för svavelväte? Vart går gränsen? Hur tolkar man tallinjen ovan?
Är 0,4=0?
Det räcker inte med att de kovalenta bindningarna är polära för att en molekyl skall vara en dipol. Metan är en molekyl med 4 polära kovalenta bindningar vars geometri är sådan att den inte är en dipol. CF4 är precis likadan fast tvärtom och värre.
Vart går gränsen och hur avläser man den tabellen?
betyder 0,4 att det är polär kovalent bindning eller att det är stark kovalent bindning? 
Jag skulle tolka det som att "0,4 är tillräckligt stor skillnad för att bindnigen skall bli märkbart polär".
Okej. Men i detta fall kan man dra slutsatsen att alla ämnen vars skillnad i elektronegativitet är 0,4 har märkbart polärt kovalent bindning. Förutom alla kolväten.
Hur många gånger skall jag förklara att anledningen till att kolväten är opolära INTE är att bindningarna inte är polära, för det är de, utan att symmetrin gör att "de tar ut varandra"?
Symmetrin gör att + laddningarna och - laddningar hamnar på samma plats..Laddningarna tar ut varandra...
Ellalisa skrev:Symmetrin gör att + laddningarna och - laddningar hamnar på samma plats..Laddningarna tar ut varandra...
Ja, precis som i koldioxid. Faller det på plats, äntligen?
ja, typ men inte helt.
Kolväten är ej dipoler pga symmetrin och inte skillnaden i elektronegativitet. 0,4 är ju polär kovalent bindning... Alltså är det symmetrin som avgör om grundämnet är en dipol. CH4.
För att ett ämne ska vara en dipol måste 2 kriterier vara uppfyllda.
kriterium 1 : Polär kovalent bindning
kriterium 2 : molekylen ska vara vinklad.
kolväten.
1) kriterium 1 är uppfylld för skillnaden i elektronegativitet är 0,4.
2) kriterium 2 är ej uppfylld för kolväten är inte vinkade utan de är symmetriska.
slutsats : kolväten är ej polära ( inga dipoler)


