Elektroner's energi
Jag greppar inte det nedan, alls. Känns väldigt förvirrande.
Jag vet detta blir lite olika frågor i samma fråga - men för mig hänger de ihop för att försöka förstå "hela bilden".
Tacksam om någon kan försöka förklara, utan för svåra fysik och kemitermer, hur jag ska tänka om nedan.
"The allowed energies (fråga 1) are specified by the principtal quantum number n. For a hydrogenic atom (fråga 2) of atomic number Z, they are given by:
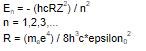
"
"Each of the wavefunctions obtained by solving the Schrödinger equation for a hydrogenic atom is uniquely labled by a set of quantum numbers. (fråga 3)"
Mina frågor:
1) Allowed energies - för vad?
2) Hydrogenic atoms och hydrogenic atomic orbitals - jag förstår inte vad detta är. Varför säger man inte bara hydrogen atoms?
Och ... hur kan man ens använda detta till, som boken skriver: "Chemists yse hydrogenic atomic orbitals to develop models that are central to the interpretation of inorganic chemistry". Den har ju bara 1 elektron och 1 proton?
3) Men dess elektron kan väl bara ha 1 vågfunktion - s orbitalen?
1). De energinivåer som elektronen i en väteatom kan ha.
2). Detta är lite mer generellt än väteatomer - det handlar om alla atomer som består av en kärna och en enda elektron, alltså även t ex en He+-jon, om man lyckas göra en sådan.
3. En elektron i en atom kan exciteras och alltså även lägga sig i en orbital med högre energi. Det är bara en väteliknande atom i sitt grundtillstånd som har elektronen i orbitalen 1s.
”Hydrogenic atom” är en atom eller jon som bara har en elektron, tex en väteatom eller en Li2+ jon. Normalt bildar ju litium +1 joner så du får se en litiumjon med laddningen +2 som ett hypotetiskt tillstånd. Orsaken är att det blir mycket enklare att lösa schrödningerekvationen om atomen bara har en elektron, så man brukar ta upp dessa exempel i grundläggande läroböcker.
Principen är att elektronerna bara kan ha diskreta energinivåer, dvs en elektron får bara ha vissa energier. Om du vill att en elektron ska gå från en orbital till en annan med högre energi måste du tillföra exakt den energiskillnaden för att hoppet ska ske. Du kan inte tillföra lite extra energi och låta elektronen göra sig av med överskottet exempelvis.
Det var Bohr som kom på att elektroner bara kunde ha vissa energier. Med ”energi” ska du tänka elektrisk potentiell energi i form av negativa elektroner bundna till en positiv kärna, ungefär som att en planet har gravitationell potentiell energi när den är bunden till solen. Den potentiella energin är större längre ut från kärnan (solen).
Innan Bohrs upptäckt trodde man att elektroner fungerade ungefär som planeter, dvs om man knuffar till dem lite så kan de få en bana utanför den gamla banan. Så fungerar alltså inte elektroner. Dels så går de inte i planetbanor och dels så måste man knuffa till dem med exakt rätt energi för att de ska hoppa upp en energinivå.
Vilka energinivåer som är tillåtna ges av Rydbergs formel som du skrev i ditt inlägg.



