Elektronformel ozon
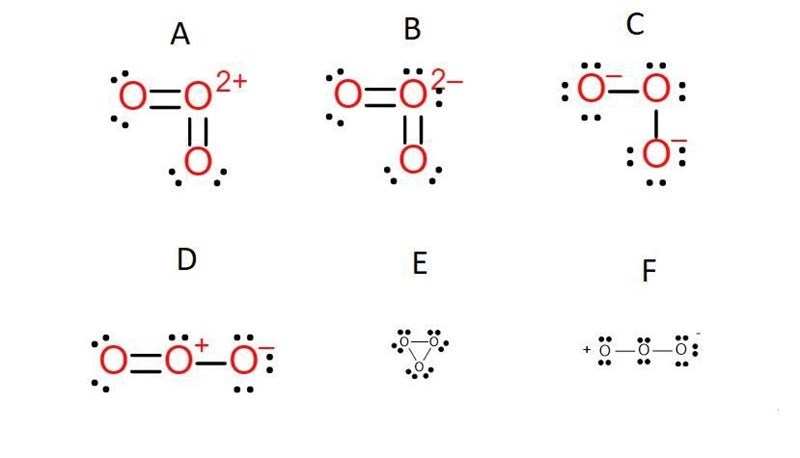
Hej jag förstår inte vilken av dessa elektronformler som är ozon. Jag tror det är antingen D eller E, men jag vet inte vilken av dem. Jag förstår inte varför någon av dem inte skulle fungera, de känns båda logiska.
D känns lite mer rätt än E, men sen kom jag på att det skulle innebära att ozon är polär. Men jag har fått lära mig att om ämnen har samma elektronegativitet så blir de opolära. Så jag vet itne 🤷♂️
(jag hittade en gammal tråd som diskuterade detta med den förklarade inte så jag tänkte att det var bäst att skapa en ny tråd än att ställa en fråga på ett fem år gammalt inlägg)
Så här ser det eg ut. Det är två strukturer den kan växla mellan. Svar D är (nästan) rätt.

varför? Varför kan det inte vara E?
Elev111 skrev:varför? Varför kan det inte vara E?
Svårt att ge ett svar på den frågan på Ke1 nivå. Det blir snabbt väldigt komplicerat och istället för att överväldigas med information tycker jag det räcker med o säga att det inte går bara. Så fort du ser triangelmolekyler kan du vara skeptisk, det är en bra tumregel tycker jag.

