empirisk formel
hej,
jag har en uppgift som jag inte förstår.
uppgiften lyder ”En organisk förening som består av kol, väte och syre förbränns fullständigt (endast koldioxid och vatten bildas). 1,367g av föreningen gav 3,002g koldioxid och 1,640g vatten. Bestäm föreningens empiriska formel.”
min enda tanke är att balansera formeln. Men jag är lite osäker på hur jag ska göra. Vid förbränning, måste då O2 vara med som enskild reaktant? Jag gjorde såhär
CHO -> CO2 + H2O
C3H8010 -> 3CO2 + 4H2O
i facit står C3H8O
hur ska jag göra?
Det första steget är att inse att förbränning innebär att ämnet reagerar med syre. Fullständig förbränning innebär att produkterna blir koldioxid och vatten. Du kan skriva formeln som CxHyOz + O2 —/—> CO2 + H2O där målet är att bestämma heltalen x, y och z.
Nästa steg är att använda lagen om massans bevarande för att räkna ut hur stor mängd syrgas som reagerade. Räkna sedan ut antalet syreatomer i syrgasen.
Fortsätt med att räkna ut antalet kol-, väte- och syreatomer bland produkterna. Alla kol- och väteatomer måste komma ifrån ämnet som förbrändes. Hur många av syreatomerna kommer ifrån ämnet som förbrändes?
Nu vet du antalet kol-, väte- och syreatomer i föreningen som förbrändes. Hur ser proportionerna mellan dessa ut?
okej då vet jag det med syret!
jag får 0,0682 mol CO3
och 0,0910 H2O
förhållandet mellan dessa är 3:4
hur menar du sen?
nu tror jag att jag missuppfattade lite! Återkommer med syrgasens massa.
massan O2 som reagerade är 3,275g. Det blir 0,1023 mol O2.
Du behöva bestämma hur många mol kolatomer och väteatomer som finns i produkterna. Ta också reda på antalet mol syreatomer i hos produkterna samt antalet i syrgasen. Differensen är antalet mol syreatomer som kom från föreningen.
Hur ska jag göra det? Jag har ju bara massan för koldioxid och vatten, inte för enbart kol eller väteatomer.
för att ta reda på antalet syrgasmolekyler tar man väl mol multiplicerat med avogadros tal? Eller hur vill du att jag ska göra?
Hur många mol kol respektive syre finns det i en mol koldioxid? Hur många mol av vardera ämne finns det då i 0,0682 mol koldioxid?
Det enda jag kommer fram till är att ta CO2 mol, 0,0682, och multiplicera med 2/3 eftersom det är 2/3 syreatomer i CO2. Är jag helt ute och cyklar?
Det är inte så det fungerar. Läs mitt inlägg här:
Har läst nu, och förstår vad du menar. Men jag är inte helt säker på att jag är med på hur jag ska komma fram till svaret.
du bad mig ta reda på antal mol av vardera ämne i varje molekyl.
av 0,0682 mol CO2 är det 0,0227 C och 0,0455 O
av 0,0910 mol H2O är det 0,0607 H och 0,0303 O
Antalet mol beskriver ett antal, inget annat. Om man skriver ”1 mol” är det egentligen bara för att det är fruktansvärt jobbigt att skriva 6,022*1023 stycken istället.
I en koldioxidmolekyl finns det en kolatom och två syreatomer. Det innebär att om du har 6,022*1023 koldioxidmolekyler så finns det 6,022*1023 kolatomer och 2*6,022*1023 syreatomer. Det är exakt samma sak som att säga att det i 1 mol koldioxid finns 1 mol kolatomer och 2 mol syreatomer.
Är du med så långt? Hur många kol- och syreatomer finns det då i 0,0682 mol koldioxid?
då finns det 4,1062*10^22 kolatomer och 8,2125*10^22 syreatomer?
Precis. Och om du ska svara i mol istället?
0,0682 mol kolatomer och 0,1364 mol syreatomer?
Bra! Gör nu ett nytt försök att beräkna detta:
Teraeagle skrev:Det första steget är att inse att förbränning innebär att ämnet reagerar med syre. Fullständig förbränning innebär att produkterna blir koldioxid och vatten. Du kan skriva formeln som CxHyOz + O2 —/—> CO2 + H2O där målet är att bestämma heltalen x, y och z.
Nästa steg är att använda lagen om massans bevarande för att räkna ut hur stor mängd syrgas som reagerade. Räkna sedan ut antalet syreatomer i syrgasen.
Fortsätt med att räkna ut antalet kol-, väte- och syreatomer bland produkterna. Alla kol- och väteatomer måste komma ifrån ämnet som förbrändes. Hur många av syreatomerna kommer ifrån ämnet som förbrändes?
Nu vet du antalet kol-, väte- och syreatomer i föreningen som förbrändes. Hur ser proportionerna mellan dessa ut?
Produkterna är alltså
0,0682 mol C
0,1364 mol O
0,182 mol H
0,0910 mol O
sammanlagt finns det 0,2274 mol O
Det finns 3,275g syrgas som reagerar med föreningen. Det innebär 0.1023 mol.
totala mängden O som finns subtraherat med hur mycket som finns i syrgasen borde bli hur många mol som finns i föreningen?
0,2274-0.1023=0,1251 mol
Stämmer detta?
Vänta åtminstone 24 timmar utan svar innan du bumpar din tråd, det står i forumreglerna.
/Mod
Det stämmer inte, men du har inte redovisat tillräckligt tydligt för att det ska gå att avgöra var du har gjort fel. Du måste träna på att visa dina beräkningar.
Om jag slår in siffrorna i WolframAlpha får jag fram 0,068 mol kol, 0,182 mol väte och 0,023 mol syre. Kan du nu hitta proportionerna mellan dessa ämnen, dvs hur många väten går det per kol och syre?
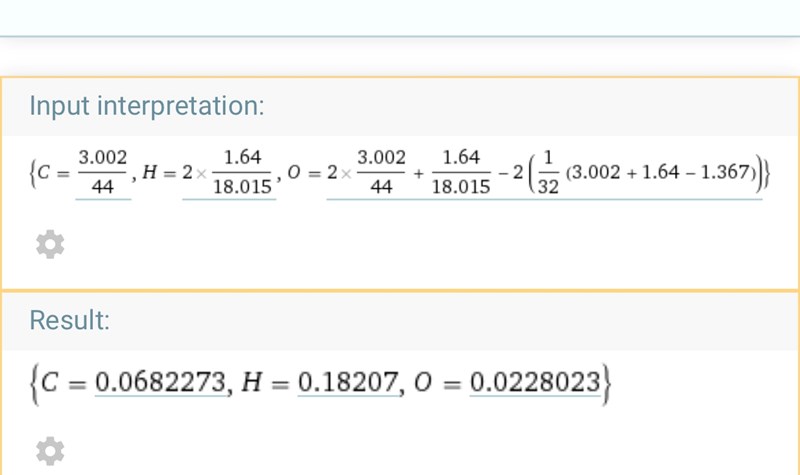
okej, jag visste inte att man kunde räkna ut mol med en massa som inte endast var för det ämnet man ville räkna ut. 3,002g är ju massan för all CO2, inte bara C.
Kan du förklara vad du gör när du räknar ut O? Är med fram tills det att du subtraherar.
okej, jag visste inte att man kunde räkna ut mol med en massa som inte endast var för det ämnet man ville räkna ut. 3,002g är ju massan för all CO2, inte bara C.
Det jag gör är att räkna ut substansmängden koldioxid (3,022/44 mol) och sedan konstaterar att det finns lika många mol kolatomer. Det är en följd av att 1 mol koldioxid innehåller 1 mol kolatomer som jag försökte att förklara tidigare.
Kan du förklara vad du gör när du räknar ut O? Är med fram tills det att du subtraherar.
Jag adderar ihop substansmängden syreatomer i vattnet och koldioxiden och subtraherar bort substansmängden som kom från syrgasen. Syreatomerna som inte kommer från syrgasen måste ha kommit från föreningen som förbrändes.
Okej, då tror jag att jag är med. Tack för hjälpen!!
Nu har jag ännu en fråga. Varför multiplicerar du syrgasens substansmängd med två? När jag räknar ut substansmängden gör jag såhär.
m(O2)=m(CO2)+m(H2O)-m(CxHyOz)
m(O2)=3,275g
n(O2)=3,275/M(O2)=0,1023
Det ger dig substansmängden syrgas, dvs syreatomer som sitter ihop två och två. För att få substansmängden syreatomer måste du multiplicera med två.
Man kan alltså använda substansmängd på två olika sätt, och det som vi gjort på betyder substansmängd atomer och inte substansmängd molekyler? Jag tycker dethär är så förvirrande, tack för ditt tålamod!
32 gram syrgas innehåller n=m/M=32/32=1 mol syrgasmolekyler. En syremolekyl innehåller två syreatomer. Man säger att ekvivalensförhållandet mellan syrgasmolekyler och syreatomer är 1:2. En mol syrgas är ekvivalent med två mol syreatomer. 1 mol syrgas innehåller 2 mol syreatomer.
Vi kan räkna bakåt för att kontrollera detta: Syreatomer har molmassan 16 g/mol. Om vi har 2 mol syreatomer finns 2*16=32 gram syre totalt.
Hänger du med?
Jag tror jag hänger med. Allting beror alltså på vad man jämför med? Du kan jämföra molförhållandet på substansmängden molekyler, men du kan också jämföra molförhållandet på substansmängden atomer?
Precis. Kontrollfråga:
Du har ett prov med 67 gram metan (CH4). Hur många mol metan respektive kol- och väteatomer innehåller provet?
n(CH4) = 4,177 mol?
n(C) = 4,177 mol?
n(H4) = 16,708 mol?
Det är rätt, men använd n(H) som beteckning istället för n(H4).


