Energinivå diagram samt våglängd, kuggfråga?
Hej! Behöver hjälp med en fråga jag tror jag löst men är osäker på huruvida jag fallit för en luring.
Frågan lyder:
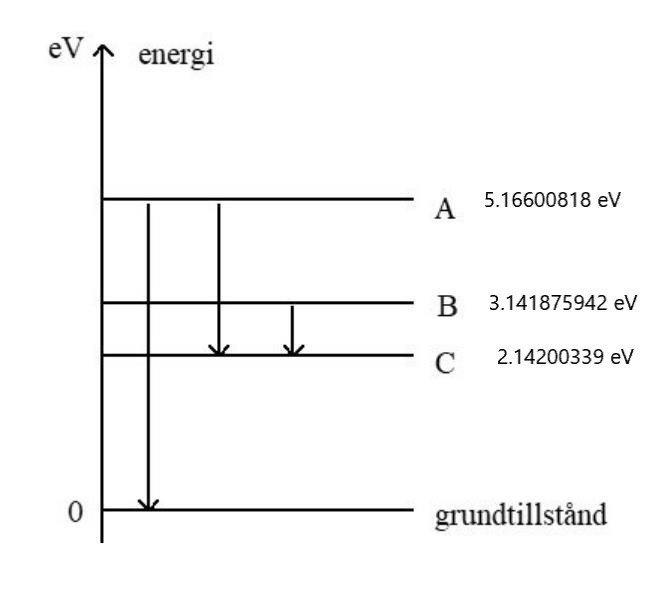
I figuren återges ett förenklat energinivådiagram för en atom. Då atomen övergår från nivå A till grundtillståndet utsänds elektromagnetisk strålning av våglängden 240 nm. Då atomen övergår från nivå B till C utsänds strålning av våglängden 1240 nm. Vid övergången från A till C utsänds strålning med våglängden 410 nm.
a)Vilken våglängd skall den strålning ha, som exciterar atomen från grundtillståndet till nivå C?
b) Vilken energi (i enheten eV) har nivån B om grundtillståndet svarar mot 0 eV?
Figuren är inte skalriktig.
Mina beräkningar (ursäkta antalet värdesiffror, tänkte runda av först när jag är säker på att jag tänkt rätt):
För att bestämma den våglängd strålningen behöver ha för att excitera atomen från grundtillståndet till nivå-C beräknar jag de olika energinivåerna (Även för att besvara fråga-(b)):
För att göra detta mindre “kladdigt” så sker beräkningar med SI-enheter varpå deras definition jag anger här:
e = 1.602176634*10^−19 J h = 6.62607015*10^−34 J*s c = 2.99792458*10^8 m/s
A till grundtillstånd: E = h*c/𝛌 → E = 8.2768576 * 10^-19 joule
eV = E/e → eV = 5.16600818 eV
A till C: E = h*c/𝛌 → E = 4.84498982 * 10^-19 joule
eV = E/e → eV = 3.02400479 eV
B till C: E = h*c/𝛌 → E = 1.60197244 * 10^-19 joule
eV = E/e → eV = 0.999872552 eV
Energin för A-nivån: 5.16600818 eV
Energin för C-nivån: 5.16600818 eV - 3.02400479 eV = 2.14200339 eV
Energin för B-nivån: 2.14200339 eV + 0.999872552 eV = 3.141875942 eV
Strålningens våglängd som exciterar atomen från grundtillståndet till nivå-C beräknas:
ΔE = 0 + 2.14200339 eV = 2.14200339 eV
ΔE = h*c/𝛌 → ΔE * 𝛌 = h*c → 𝛌 = h*c/ΔE
𝛌 = 578.823535 nm
Det jag är osäker på är om atomen inte redan är i ett exciterat tillstånd då grundtillståndet har en energinivå på 0 eV och elektronen därav inte kräver någon tillförd energi från fotonen för att "hoppa" till C-nivån? Jag kanske övertänker frågan, men är tillräckligt osäker för att starta en tråd. För om så är fallet bör ju svaret vara 𝛌 = 0 och inte:𝛌 = 578.823535 nm
Grundtillståndet är aldrig exciterat, det är definitionsmässigt.
Du har att , d v s . Välj värdet på k så att du kan sätta in våglängden i nm och energin i eV, så blir det mindre kladdigt.
Åh, tack för tipset ang. kladdigheten! Tror jag förstår, tolkar det då som att svaret är korrekt för fråga a) 𝛌 = 578.823535 nm.
Osäker på om det bryter mot reglerna att fråga en till sak, isåfall ta bort detta inlägg.
Frågan lyder: Nu har jag fått de olika nivåerna till en viss eV, men jag har för mig att elektronladdningen alltid är negativ. Är det frågans teoretiska utformning som gör att jag får positiva värden eller har jag gjort fel genom att benämna energinivåerna som positiva?
Ps. Tack för all hjälp Smaragdalena, har läst andra trådar för kurser jag pluggat upp och måste säga vilken fantastisk insats du och alla andra här på pluggakuten gör!
Nu har jag fått de olika nivåerna till en viss eV, men jag har för mig att elektronladdningen alltid är negativ.
Om du menar att elektronens laddning är negativ, så är det korrekt, men jag tror inte att det är det du menar egentligen.
Normalt sett brukar man sätta energin för en elektron sm inte är bunden till en kärna till 0, så det är lite ovanligt att man sätter energin för grundtillständet till 0.
Smaragdalena skrev:Nu har jag fått de olika nivåerna till en viss eV, men jag har för mig att elektronladdningen alltid är negativ.
Om du menar att elektronens laddning är negativ, så är det korrekt, men jag tror inte att det är det du menar egentligen.
Normalt sett brukar man sätta energin för en elektron sm inte är bunden till en kärna till 0, så det är lite ovanligt att man sätter energin för grundtillständet till 0.
Det var elektronens laddning jag menade, tror jag fått det inbankat i skallen från kemin och snurrat ihop saker o ting. Antar att jag inte kunde förena uppgiften med iden om att protonerna är positivt laddade och därav "drar till sig" elektronerna som är negativt laddade och beroende på elektronens laddning så dikterar det vilken orbital den tillhör. Alltså, för att elektronen ska frigöras eller "hoppa" till en yttre orbital ska energi tillföras- resulterar det då i att den negativa laddningen för elektronen ökar?
Nej, elektronens laddning är konstant och ändras inte.


