1
svar
112
visningar
852sol behöver inte mer hjälp
Entalpidiagram
Hej, varför blir delta h är 672 kJ när bindningarna går isär. Hur kan bindningsenergin för reaktanterna vara lika med delta h för när bidningarna går isär, måste man inte ha differensen av bidningsenergin reaktanterna och bindningsenergin produkterna för att beräkna delta h?
Tack på förhand
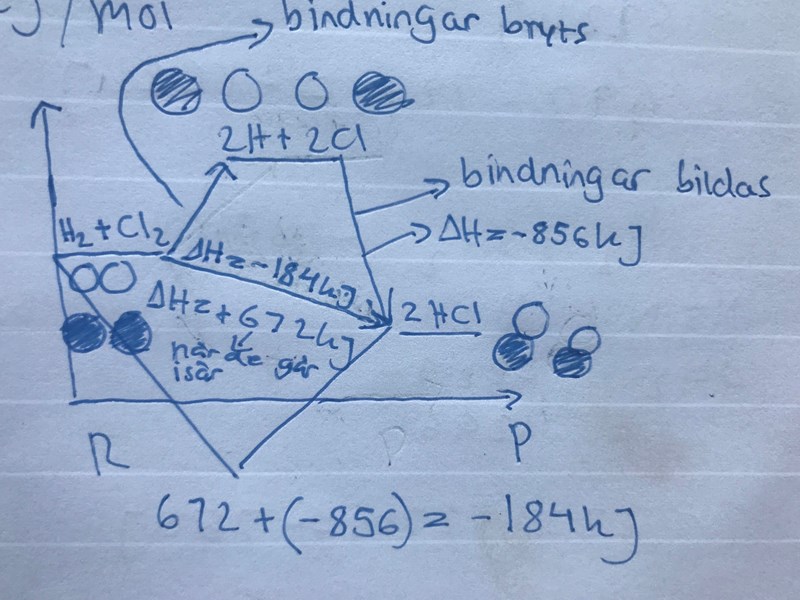
Jo, man tar skillnaden mellan produkter och reaktanter för att ta reda på reaktionens/stegets entalpiändring. Du har ju en klorgasmolekyl och en vätgasmolekyl som delas upp i två fria kloratomer och två fria väteatomer. Molekylerna hade från början bindningsenergin 672 kJ. När de finns som fria atomer har de bindningsenergin 0 kJ eftersom, tja, det finns inga bindningar.
672-0=672


