entalpiförändringar
Beräkna
F → G
Om följande gäller:
E → 2F ΔH = −400 kJ/mol
E → 2G ΔH = −600 kJ/mol
facit: -100 kJ/mol
Hur ska man tänka här? jag har försökt på egen hand på det här sättet:
= Hprodukter - Hreaktanter
båda reaktionerna är exoterma, så
E i reaktion 1 = (x + 400 kJ/mol)
E i reaktion 2 = (x + 600 kJ/mol)
2F 2G
eftersom E blir till 2F och 2G, tänkte jag att man kunde byta ut dem?
x + 400 kJ/mol x + 600 kJ/mol
x försvinner bort, dela allt på 2
200 kJ/mol 300 kJ/mol
=100kJ/mol
istället för ett negativt värde har jag fått ett positivt
Som vanligt: Rita!
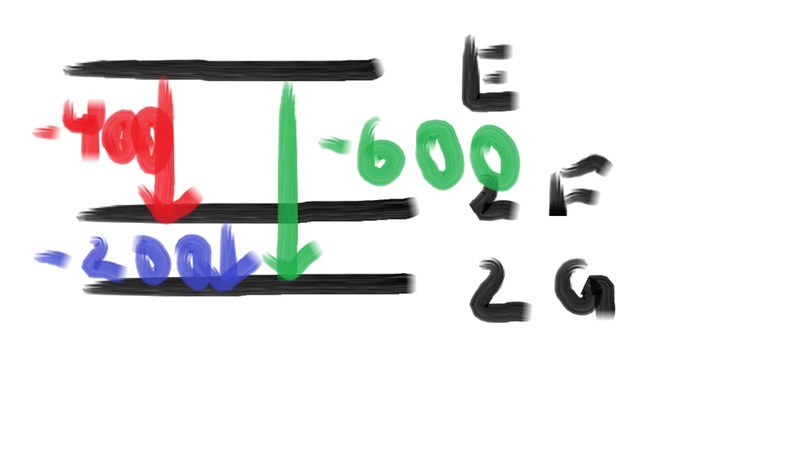
aha, förstår!
2F2G =-200kJ/mol
(dela allt på 2) FG =-100kJ/mol
tack :)
Jag vågar sällan göra energiberäkningar utan att rita lite, det är så lätt att det blir fel annars.


