Enzymkinetik - vad ska jag ha på grafen...
Hej, jag håller på att skriva labbrapport om enzymkinetik och ska ha med en graf. Men jag vet inte vad jag ska ha på y- och x-axeln. Min kemilärare sa att den ska ungefär se ut såhär, men hur får jag fram "reaction time" (heter det reaktionstid på svenska då?)?:
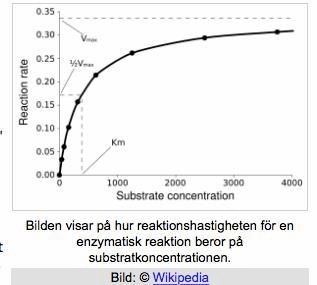
Grafen på bilden har ingen ”reaction time”. Vad vill du att grafen ska visa?
Egentligen så vet jag inte vad det är för graf jag vill ha. Det jag undersöker i min labb är hur enzym- respektive substratkoncentration kan påverka reaktionshastigeheten då substratet väteperoxid bryts ned av enzymetet katalas till produkterna vatten och syrgas enligt följande reaktionsformel
H2O2 (l) → H2O (l) + O2 (g)
Jag har då gjort två försök, ett där jag varierade mängden substrat men enzymet var konstant. I det andra försöket varierade jag mängden enzym, men höll substratet konstant.
Det jag kommer ihåg från min lärare är att hon sa att den skulle se ut som på bilden jag har tagit med ovan.
Vilka saker har du mätt? Det bästa är nog att plotta koncentrationen av någon produkt (eller reaktant) på y-axeln och tiden på x-axeln. Med lite mattetrix kan man sen ta fram en reaktionshastighetskonstant.
Jag hittade detta från labbdagen. Det är min lärare som har skrivit det på tavlan.

Såhär blev mätvärdena (vikterna står för olika mängd enzym):
- Men det jag inte fattar är om enzymet är konstant kommer man inte få en vertikal linje eller är det meningen att man ska slå ihop alla mätvärden i en graf?
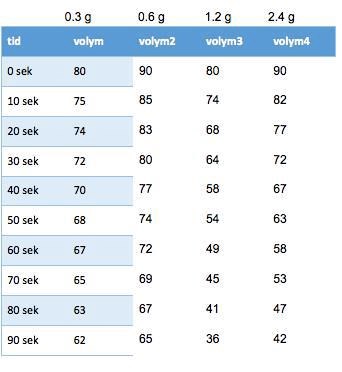
Du måste ta reda på reaktionshastigheten vid varje enzymkoncentration till att börja med. Hur ser det ut om du tar tiderna på x-axeln och en av serierna med volymer som y-värden? Gör en graf med detta i Excel.
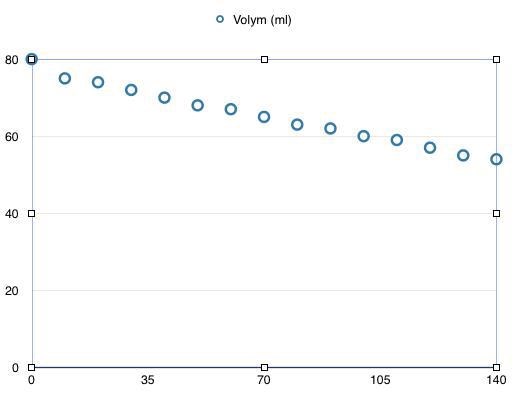
Jag började att göra för det första, när jag hade 0,3 g enzym och då fick jag såhär:
Volym som y och tid som x. Men det blir fortfarande inte som hon vill ha den
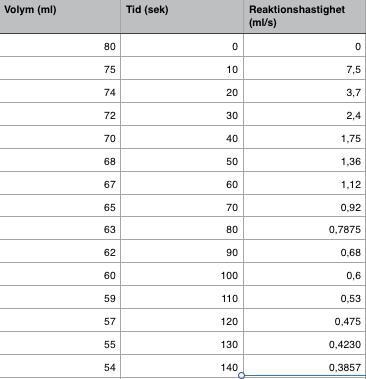
EDIT: Jag räknade ut reaktionshastigheten (ml/s) som det stod på tavlan och la in värdena i en tabell:
EDIT2: Hur kan man få substrat/enzym koncentration? Ska man beräkna fram det?
EDIT 3: Här är en bild (inte min) som visar hur vi gick tillväga ungefär...

Nu kan du se att punkterna ligger längs en rät linje. Då kan du lägga in en linjär trendlinje och visa dess ekvation. Den visar hur volymen minskar med tiden. Koefficienten framför x är anger reaktionshastigheten i ml/s. Linjens lutning motsvarar alltså reaktionshastigheten. Gör på motsvarande sätt för de andra enzymmängderna och notera koefficenternas värden.
Sedan gör du en ny graf med enzymmängden som x-värde och reaktionshastigheterna du läste av tidigare som y-värden.
Edit: Nu förstår jag varför volymen minskar med tiden. I graferna ska du ha in gasvolymerna, dvs mätcylinderns volym minus volymerna i din tabell.
Okej, jag ska göra det för de andra också så att jag får fram ”k” värdet. Men för det första fick jag negativt, dvs linjens ekvation blev y= -0,1732x + 77,525. Kan den vara negativ?
EDIT: menar du då 100 ml - 80 ml = 20 ml ? Är det den volym jag ska ha på y-axeln i volym-tid-graf
Ja, det är så jag menar men jag får inte riktigt ihop hur du har mätt volymen. Bubblade ni gasen in i mätglaset och läste av? För i så fall borde ju gasvolymen öka med tiden och inte tvärt om. Eller är det volymen av något annat som står i tabellen?
Vi hade fyllt mätcylinder med vatten och vände den upp och ner som bilden ovan visar, sedan läste vi av nollnivån och så såg vi att vattennivån sjönk mer och mer ju mer tiden hade gått. Blev det till syrgas då?
Väteperoxiden i e-kolven sönderfaller till vatten och syrgas. Syrgasen leds in i mätglaset där den trycker undan vattnet.
Men som jag skrev tidigare: cylinderns volym minus vattnets volym ger dig gasens volym och det är den du ska räkna med. Då får du en positiv lutning.
Det står ju på bilden av whiteboard-tavlan att reaktionen är (fast reaktionen är obalanserad, det skall vara 2 väteperoxid och 2 vatten). Ja, det bildas syrgas. När vattenytan har sjunktit från 80 ml till 75 ml beror det på att det har bildats 5 ml syrgas.
Smaragdalena skrev :Det står ju på bilden av whiteboard-tavlan att reaktionen är (fast reaktionen är obalanserad, det skall vara 2 väteperoxid och 2 vatten). Ja, det bildas syrgas. När vattenytan har sjunktit från 80 ml till 75 ml beror det på att det har bildats 5 ml syrgas.
Det jag inte riktigt får ihop är varför volymen minskar. Volymskalan borde ju öka nedåt såsom mätglaset är vänt.
Teraeagle skrev :Smaragdalena skrev :Det står ju på bilden av whiteboard-tavlan att reaktionen är (fast reaktionen är obalanserad, det skall vara 2 väteperoxid och 2 vatten). Ja, det bildas syrgas. När vattenytan har sjunktit från 80 ml till 75 ml beror det på att det har bildats 5 ml syrgas.
Det jag inte riktigt får ihop är varför volymen minskar. Volymskalan borde ju öka nedåt såsom mätglaset är vänt.
Min tolkning är att man har läst av vattnets volym, inte gasens. Då minskar vattenvolymen allt eftersom gasvolymen ökar.
Ja, det är min tolkning också även fast det är märkligt. Man kan ju bara läsa av gasens volym och inte vattnets, så för att få fram vattnets volym måste man ta mätglasets volym minus uppmätt gasvolym.
detrr, har du räknat ut volymerna i tabellen eller är det exakt vad ni läste av på glaset?
Jag läste volymen på mätcylindern.
detrr skrev :Jag läste volymen på mätcylindern.
Skumt, men det ser i alla fall rätt ut om du tar mätglasets volym minus volymerna i tabellen och räknar med värdena du får fram istället. Gör det för varje serie med volymer och ta fram linjernas lutningar. Gör sedan en ny graf med linjernas lutningar som y-värden och motsvarande mängder med enzym som x-värden.
Aa, jag gjorde det och såhär blev min nya graf med reaktionshastigheterna på y-axeln och enzymmängd på x-axeln. Men kan den vara så eller ska man ha den från noll?
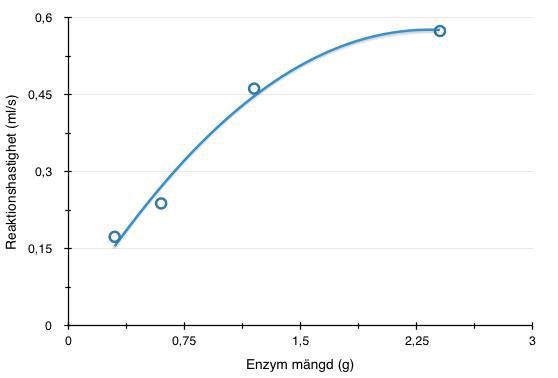
Nej, den ser bra ut! Kurvan behöver inte börja i origo eftersom det skulle betyda att väteperoxid inte alls kan sönderfalla utan närvaro av enzym. Det vet vi inte säkert.
Vad drar du för slutsatser utifrån grafen?
Reaktionshastigheten för substratet väteperoxid ökar i början men eftersom vi har en bestämd mängd enzym katalas kommer vi nå en punkt då reaktionshastigheten inte kommer att öka för att alla enzym-molekyler är upptagna.
Fast kurvan visar att vi inte alls har en bestämd mängd enzym. Reaktionshastigheten planar ut mot ett konstant värde trots att vi ökar mängden enzym.
Ja det är sant iförsig, men jag fattar inte varför det blir så. Har det något med substraten att göra?
Ja, det är nog en ”köbildningseffekt”. Om du tittar på kurvan så är den nästan linjär i början där fördubblad enzymmängd ger fördubblad reaktionshastighet. Till slut finns så många enzymplatser att reagera på att skillnaden inte blir lika stor om man tillför ännu fler platser. Det är alltså stor skillnad på, låt säga 10 eller 20 platser men både 1000 eller 2000 är ändå så många att det inte gör lika stor skillnad. Hastigheten är ändå så hög redan vid 1000 enzymplatser. Siffrorna lär vara större i verkligheten än i mitt exempel men principen är densamma.
En annan liknelse kan vara antalet filer på en väg. En väg med två filer har dubbelt så hög kapacitet för biltrafik som en enfilig väg, men om man har 10 eller 20 filer så är det ändå så pass många att man aldrig kan komma upp i så många bilar att det gör skillnad.
Följdfråga: finns det något annat man skulle kunna göra för att öka reaktionshastigheten ytterligare? Det finns åtminstone två viktiga faktorerer man kan ändra.
Okej, jag förstår.
Svar på din följdfråga; Reaktionshastigheten borde väll öka om man finfördelade levern med enzymet samt öka substratkoncentrationen. Är det rätt tänkt eller är jag helt ute och cyklar?
EDIT: I min kemibok står det såhär
Vid en viss koncentration av substrat är alla enzymmolekyler bundna i enzym-substratkomplex. Reaktionen går då inte fortare av att koncentrationen substrat ökas.
I mitt fall då var substratkoncentrationen konstant och enzymmängden varierades. Kan man då formulera om det och säga; Vid en viss koncentration av enzym är alla substratmolekyler bundna i ett enzym-substratkomplex. Reaktionen går då inte fortare av att koncentrationen enzym ökar, vilket kan ses i grafen. ???
detrr skrev :Okej, jag förstår.
Svar på din följdfråga; Reaktionshastigheten borde väll öka om man finfördelade levern med enzymet samt öka substratkoncentrationen. Är det rätt tänkt eller är jag helt ute och cyklar?
Om man finfördelar något ökar man reaktionsytan, vilket normalt ökar reaktionshastigheten. Nu har vi dock så mycket enzym att ytterligare reaktionsytor inte spelar någon större roll enligt din graf.
Däremot håller jag helt klart med om att högre substratkoncentration ger snabbare reaktion. Vad säger du om temperaturen?
detrr skrev :EDIT: I min kemibok står det såhär
Vid en viss koncentration av substrat är alla enzymmolekyler bundna i enzym-substratkomplex. Reaktionen går då inte fortare av att koncentrationen substrat ökas.
I mitt fall då var substratkoncentrationen konstant och enzymmängden varierades. Kan man då formulera om det och säga; Vid en viss koncentration av enzym är alla substratmolekyler bundna i ett enzym-substratkomplex. Reaktionen går då inte fortare av att koncentrationen enzym ökar, vilket kan ses i grafen. ???
Nej, det är snarare tvärt om. Vid en viss enzymkoncentration kommer ytterligare ökning leda till att enzymerna har lediga reaktionsytor eftersom det inte finns nog med substrat som hinner fylla alla platserna. Om man tillför mer enzym kommer konsekvensen bli att man t.ex. har 10 lediga platser istället för 5.
Teraeagle skrev :detrr skrev :Okej, jag förstår.
Svar på din följdfråga; Reaktionshastigheten borde väll öka om man finfördelade levern med enzymet samt öka substratkoncentrationen. Är det rätt tänkt eller är jag helt ute och cyklar?
Om man finfördelar något ökar man reaktionsytan, vilket normalt ökar reaktionshastigheten. Nu har vi dock så mycket enzym att ytterligare reaktionsytor inte spelar någon större roll enligt din graf.
Däremot håller jag helt klart med om att högre substratkoncentration ger snabbare reaktion. Vad säger du om temperaturen?
Ja, temperaturen borde också spela roll. Om man höjer temperaturen kommer substratmolekylerna få en högre rörelseenergi vilket kan öka sannorlikheten för att den ska träffa enzymets aktiva centrum? Men reaktionen är ju exoterm
Teraeagle skrev :detrr skrev :EDIT: I min kemibok står det såhär
Vid en viss koncentration av substrat är alla enzymmolekyler bundna i enzym-substratkomplex. Reaktionen går då inte fortare av att koncentrationen substrat ökas.
I mitt fall då var substratkoncentrationen konstant och enzymmängden varierades. Kan man då formulera om det och säga; Vid en viss koncentration av enzym är alla substratmolekyler bundna i ett enzym-substratkomplex. Reaktionen går då inte fortare av att koncentrationen enzym ökar, vilket kan ses i grafen. ???
Nej, det är snarare tvärt om. Vid en viss enzymkoncentration kommer ytterligare ökning leda till att enzymerna har lediga reaktionsytor eftersom det inte finns nog med substrat som hinner fylla alla platserna. Om man tillför mer enzym kommer konsekvensen bli att man t.ex. har 10 lediga platser istället för 5.
Men kommer det bidra till att reaktionshastigheten blir lägre? Den borde då bli oförändrad eftersom vi ändå inte har tillräckligt med substrat.
detrr skrev :Teraeagle skrev :detrr skrev :Okej, jag förstår.
Svar på din följdfråga; Reaktionshastigheten borde väll öka om man finfördelade levern med enzymet samt öka substratkoncentrationen. Är det rätt tänkt eller är jag helt ute och cyklar?
Om man finfördelar något ökar man reaktionsytan, vilket normalt ökar reaktionshastigheten. Nu har vi dock så mycket enzym att ytterligare reaktionsytor inte spelar någon större roll enligt din graf.
Däremot håller jag helt klart med om att högre substratkoncentration ger snabbare reaktion. Vad säger du om temperaturen?
Ja, temperaturen borde också spela roll. Om man höjer temperaturen kommer substratmolekylerna få en högre rörelseenergi vilket kan öka sannorlikheten för att den ska träffa enzymets aktiva centrum? Men reaktionen är ju exoterm
Att den är exoterm har bara betydelse ur ett jämviktsperspektiv. I det här fallet är det inte fråga om någon jämvikt heller, eftersom syrgas och vatten inte återbildar väteperoxid (i så fall skulle alla vattendrag på jorden vara fyllda med väteperoxid) pga löst luft). Ökad temperatur ger högre reaktionshastighet, men eftersom enzymer är proteiner får man se till att inte öka den för mycket. Det finns en optimal temperatur då ett enzym har maximal aktivitet, oftast kroppstemperatur.
detrr skrev :Teraeagle skrev :detrr skrev :EDIT: I min kemibok står det såhär
Vid en viss koncentration av substrat är alla enzymmolekyler bundna i enzym-substratkomplex. Reaktionen går då inte fortare av att koncentrationen substrat ökas.
I mitt fall då var substratkoncentrationen konstant och enzymmängden varierades. Kan man då formulera om det och säga; Vid en viss koncentration av enzym är alla substratmolekyler bundna i ett enzym-substratkomplex. Reaktionen går då inte fortare av att koncentrationen enzym ökar, vilket kan ses i grafen. ???
Nej, det är snarare tvärt om. Vid en viss enzymkoncentration kommer ytterligare ökning leda till att enzymerna har lediga reaktionsytor eftersom det inte finns nog med substrat som hinner fylla alla platserna. Om man tillför mer enzym kommer konsekvensen bli att man t.ex. har 10 lediga platser istället för 5.
Men kommer det bidra till att reaktionshastigheten blir lägre? Den borde då bli oförändrad eftersom vi ändå inte har tillräckligt med substrat.
Ja, jag menade att den kommer vara oförändrad. Det kanske inte riktigt framgick i mitt inlägg.
Okej, då förstår jag. TAAAAAACK så hemskt mycket för hjälpen! :D




