Förbränning av ämne med överskott av syrgas
Hej! Jag såg att en annan användare hade samma problem men utan lösning.
Uppgiften lyder:

Ämnet jag har är glykol och då fick jag den balanserade reaktionsformeln till:
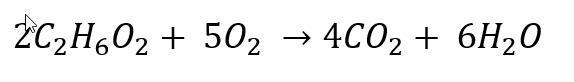
Problemet är att jag inte riktigt förstår hur jag ska räkna ut massan som kan förbrännas med hjälp av endast den här informationen. Jag gissar på att det har med molförhållanden att göra men förstår inte riktigt hur allt ska appliceras. Molförhållandet mellan glykolen och syrgas är 2:5 och eftersom jag har ett överskott av syrgas så tar ju den aldrig slut, utan det är glykolen som tar slut först. Hur ska man tänka för att lösa uppgiften?
- Hur många mol glykol har du?
- Hur många mol syrgas skulle gå åt om det skulle gå exakt jämnt upp, dvs ingen glykol eller syrgas finns kvar efteråt?
- Hur mycket är 20% mer än det du räknade ut i steg 2?
- Hur mycket väger den mängden syrgas?
Kom att tänka på, molmassan för glykol är 62,008 och för syrgas 32,00. Dvs 1 mol glykol väger 62.008 g respektiva syrgas som väger 32,00 g. Eftersom molförhållandet mellan dessa två är 2:5, ska man då räkna 62,008*2/32*5 för att få ut procenten av glykol som förbränns i den här reaktionen? Det blir 77,51%. så eftersom det är två mol glykol som används så blir det 77,51% av 124,016 g (glykols molmassa *2) som är massan som förbränns?
Edit: Om syrgasen som är i överskott ska räknas med i ekvationen så blir det väl att molförhållandet är 2:6 istället för 2:5, men är tankesättet rätt eller är jag helt fel ute?
SvanteR skrev:
- Hur många mol glykol har du?
- Hur många mol syrgas skulle gå åt om det skulle gå exakt jämnt upp, dvs ingen glykol eller syrgas finns kvar efteråt?
- Hur mycket är 20% mer än det du räknade ut i steg 2?
- Hur mycket väger den mängden syrgas?
1. 2 mol glykol
2. Jag tror att jag glömde av att skriva i O2 i högerledet av reaktionsformeln. Så borde det ha blivit
![]()
och om all syrgas ska ha gått åt så borde det ha blivit som min första reaktionsformel?
3. Vilket är steg 2 som du referar till? :) Jag vet inte riktigt hur jag ska tänka på det med 20% i överskott, har för mig att min lärare sa att den var försumbar i reaktionen?
Ditt steg 2! Hur många mol syrgas förbrukas vid reaktionen med 2 mol glykol?
SvanteR skrev:Ditt steg 2! Hur många mol syrgas förbrukas vid reaktionen med 2 mol glykol?
Oj, vad dum jag är haha. Det blir 5 mol syrgas om inga restprodukter ska finnas. Och 20% av 5 mol blir 1 mol syrgas som väger 32,00 g. Hur kan jag använda mig av detta för att komma vidare?
Jättetacksam för all hjälp!
Finns det något mer som du inte har tagit med? Så som frågan är ställd i ditt förstainlägg går det inte att svara på den - det behövs t ex att man har en begränsad mängd syrgas till sitt förfogande.
Smaragdalena skrev:Finns det något mer som du inte har tagit med? Så som frågan är ställd i ditt förstainlägg går det inte att svara på den - det behövs t ex att man har en begränsad mängd syrgas till sitt förfogande.
Nej, det enda jag har fått för information är uppgiftsinformationen som jag bifogade samt ämnet man ska undersöka massan utav.
Nu kom jag ioförsig på att mina svar till SvanteR baserar sig på att jag har ett visst antal mol glykol, vilket jag faktiskt inte har. Jag gjorde antogandet att glykolen är 1 mol från början och efter att jag balanserade formeln så blev det 2 mol glykol. Går det att räkna på det sättet eftersom inga andra uppgifter är givna eller får man inte göra sådana antagande?
Verkar som att det var svårt att hitta en lösning på det här :(
Jag har bara en tanke, eftersom syrgasen är det som är i överskott, kommer inte all glykol att förbrukas eftersom det är den begränsande reaktanten?
Det är det vi (eller åtminstone jag) försöker säga. Om det inte finns någon begränsning i hur mycket syrgas man har, så kan man förbränna hur mycket glykol som man vill.
Beklagar mitt sena svar men jag glömde tråden...
När jag läser er diskussion så inser jag att jag inte läste den ursprungliga frågan ordentligt. Jag missförstod och fick för mig att man frågade efter hur mycket syre man hade från början om man hade 20% överskott. I så fall är ju svaret 6 mol (5 + 1).
Men nu ser jag att det inte är det man frågar efter, och därför håller jag med Smaragdalena.


