Fråga angående lösningsförslag

Hej försökte lösa denna uppgift, men blev lite fundersam på lösningsförslaget.
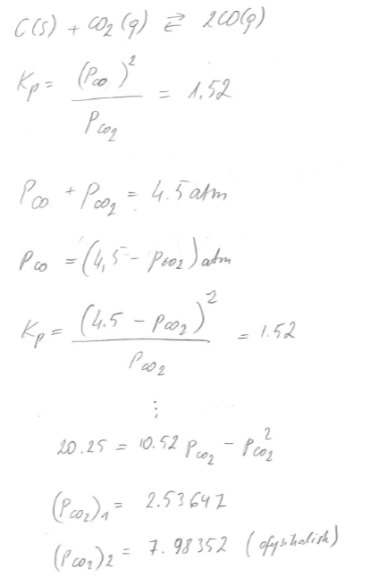
Varför ställer man upp
P(CO) + P(CO2) = 4,5 atm
Borde det inte vara
P(CO) + 2P(CO2) = 4,5 atm eftersom det är två mol CO för varje mol CO2?
Eller tänker jag fel?
Ja, vanligtvis finns det 2 CO i ekvationen för Boudouard-reaktionen.
C + CO2 <=> 2 CO
Zockimon skrev:Ja, vanligtvis finns det 2 CO i ekvationen för Boudouard-reaktionen.
C + CO2 <=> 2 CO
Det bör alltså vara:
P(CO) + 2P(CO2) = 4.5 atm
som är den korrekta ekvationen att använda här?
Nej, det finns så mycket koldioxid som det finns, inte dubbelt så mycket! Uttrycket för jämviktskonstanten är något annat.
Ups, det var kanske lätt att missförstå.
Jag tittade på reaktionen i uppgiften och den borde egentligen vara
C (s) + CO2 (g) <=> 2 CO (g)
4,5 atm är ju trycket som finns i reaktionskärlen och den är en kombination av tryck av båda gaser. Hur stor de är vet man ju inte. Kanske man har börjad med en överskott CO2 i början för att producera mer CO.
därmed
P(CO) + P(CO2) = 4,5 atm
Att det finns 2 CO speglas i jämnviktskonstanten där CO bidrar med [CO]2, vilket leder till andra ekvationen som behövs för att beräkna partialtrycken.



