fråga om molekylers geometriska form.

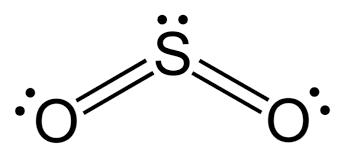
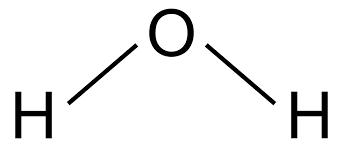
jag har lärt mig att man kan se om en polär kovalent binding är en dipol eller ej genom att se om den centrala atomen har en fria elektronpar eller inte. Om det har det kommer det att inta en vinklad position och därmed kan man dra dipole samt net dipole moment och konstatera att det är en dipol. Varför det så? varför positioneras den centrala atomen över ligand atomerna?
Varför man ritar den centrala över har egentligen ingen betydelse. Du kan ju vrida molekylen hur du vill i rymden. I den översta figuren har man använt en metod för att kunna tänka sig hur molekylen ser ut i 3D.
Elektronerna som ritas som prickar är egentligen elektronmoln, eller sk orbitaler (som beskriver "elektrontätheten" om man så vill, eller elektonernas "bana", skalmodellen med cirklar runt atomerna är en modell som inte geometriskt alls motsvarar verkligheten, men som modell är den användbar ändå ibland).
Att vissa molekyler föredrar en vinklad struktur beror på hur den totala "laddningssituationen" ser ut, dvs hur elektronmolnens geometri ser ut. Detta i sin tur beror på hur atomernas elektronmoln växelverkar, dvs hur de känner av varandra rent elektrostatiskt, samt även hur de positiva kärnorna bidrar till denna "balans". Molekylen hamnar i det läge som minimerar energin kan man säga. Skulle man vilja räta ut en vattenmolekyl så måste man tillföra energi, eller om man så vill utföra ett arbete mot en elektrisk kraft.
Det är "tävlingen" mellan attraktionen mellan elektroner och kärnans protoner samt repulsionen mellan elektronerna som totalt sett gör att en molekyl hamnar i det "tillstånd" som är förenligt med lägst energi.
Vissa molekyler ändrar sin struktur om man byter lösningsmedel pga detta.
Pelle skrev:Varför man ritar den centrala över har egentligen ingen betydelse. Du kan ju vrida molekylen hur du vill i rymden. I den översta figuren har man använt en metod för att kunna tänka sig hur molekylen ser ut i 3D.
Elektronerna som ritas som prickar är egentligen elektronmoln, eller sk orbitaler (som beskriver "elektrontätheten" om man så vill, eller elektonernas "bana", skalmodellen med cirklar runt atomerna är en modell som inte geometriskt alls motsvarar verkligheten, men som modell är den användbar ändå ibland).
Att vissa molekyler föredrar en vinklad struktur beror på hur den totala "laddningssituationen" ser ut, dvs hur elektronmolnens geometri ser ut. Detta i sin tur beror på hur atomernas elektronmoln växelverkar, dvs hur de känner av varandra rent elektrostatiskt, samt även hur de positiva kärnorna bidrar till denna "balans". Molekylen hamnar i det läge som minimerar energin kan man säga. Skulle man vilja räta ut en vattenmolekyl så måste man tillföra energi, eller om man så vill utföra ett arbete mot en elektrisk kraft.
Det är "tävlingen" mellan attraktionen mellan elektroner och kärnans protoner samt repulsionen mellan elektronerna som totalt sett gör att en molekyl hamnar i det "tillstånd" som är förenligt med lägst energi.
Vissa molekyler ändrar sin struktur om man byter lösningsmedel pga detta.
Tack för svaret!


