Fysik 1 universitet/termodynamik - Fråga angående andra huvudsatsen och entropi
Hej! Har suttit och klurat och googlat på samma fråga i över en timme utan något svar, så nu försöker jag här. Frågan lyder:
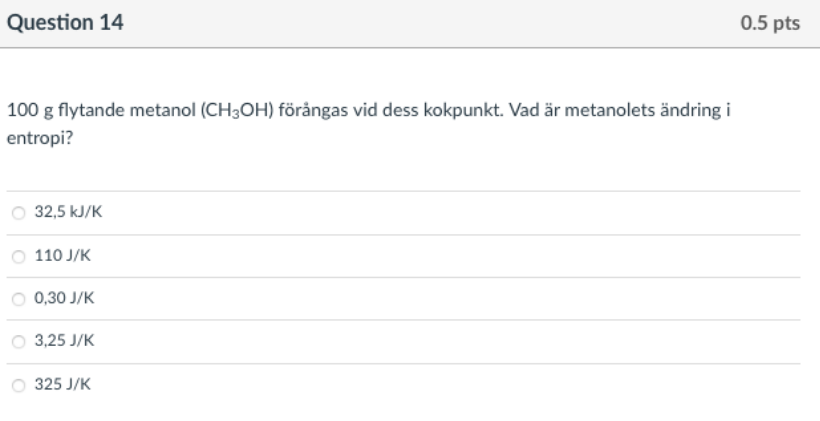
100g flytande metanol förångas vid dess kokpunkt. Vad är metanolets ändring i entropi?
Jag har kommit fram till att det bör vara , som skall användas, men jag förstår inte hur man använder den formeln. I alla liknande exempel på engelska kallar dem för , (tror jag) och har den alltid given till typ 35.2 KJ/mol. Har testat lite med att beräkna värmemängden Q från flytande till gasform (16.2 KJ) men sen säger dem att man ska addera den med "Full evaporation of methanol" i nåt exempel jag hittade, där just Hvap behövs.. Gissar på att denna process är reversibel också, vilket ger dS = 0
Tacksam för hjälp, jag är verkligen helt lost på denna fråga. Hängde aldrig riktigt med i värmelära-delen när vi läste kursen.
Ja, använd kokvärmet och kokpunkt.
Vilken kurs läser du? Det här ser inte ut som gymnasiekursen Fy1. Du kan själv flytta tråden till rätt nivå genom att redigera ditt förstainlägg (inom 2 timmar).
Pieter Kuiper skrev:Ja, använd kokvärmet och kokpunkt.
Ska testa!
Smaragdalena skrev:Vilken kurs läser du? Det här ser inte ut som gymnasiekursen Fy1. Du kan själv flytta tråden till rätt nivå genom att redigera ditt förstainlägg (inom 2 timmar).
Det är Fy1 på universitet, ursäkta om jag postat fel. Ska lägga den rätt!
Haxelll skrev:Pieter Kuiper skrev:Ja, använd kokvärmet och kokpunkt.
Jag använde nu formeln , kollade i min vackra tabell och kom fram till detta:
Svarsalternativen finns på bilden nedan:
För det första ska svaret vara i J/K, vilket jag inte är nära. För det andra, om jag adderar de bägge två processerna (vätska -> ånga, ånga -> helt evaporerad) landar jag i 126000 J. Vart ligger felet nu?
EDIT: Jag insåg att J/K är enheten för Entropi S. Men jag förstår ändå inte riktigt hur jag ska ställa upp allt, vad mitt blir osv. Såhär skulle jag skriva nu:
(1)
(2)
(3)
Vilket T används i nämnaren? 273.15K eller 338K? Är i ekv (2) eller enbart 338K?
Haxelll skrev:Det är Fy1 på universitet, ursäkta om jag postat fel. Ska lägga den rätt!
Hmm vilket dilemma... Är det tekniskt basår?
Qetsiyah skrev:Haxelll skrev:Det är Fy1 på universitet, ursäkta om jag postat fel. Ska lägga den rätt!
Hmm vilket dilemma... Är det tekniskt basår?
Faktiskt inte, högskoleingenjör bilsystemteknik! Men gissar på att samma frågor dyker upp i TB.
Peter skrev vad du skulle göra men det kanske var svårt att tyda.
Angående vad du känner igen sen tidigare har du att förångningsentalpin (vilken brukar kallas Heat of vaporization eller som Peter kallade "kokvärmet") är relaterad till med kokpunkten :
Du får alltså förändringen av entropi vid förångning från förångningsentalpin. Detta ger med ditt värde på kokvärmen och kokpunkten på ca 64 °C följande:
Tabell ger för metanol:
Du kan sedan slå upp molmassan för metanol och enkelt lösa uppgiften.
Ebola skrev:Peter skrev vad du skulle göra men det kanske var svårt att tyda.
Angående vad du känner igen sen tidigare har du att förångningsentalpin (vilken brukar kallas Heat of vaporization eller som Peter kallade "kokvärmet") är relaterad till med kokpunkten :
Du får alltså förändringen av entropi vid förångning från förångningsentalpin. Detta ger med ditt värde på kokvärmen och kokpunkten på ca 64 °C följande:
Tabell ger för metanol:
Du kan sedan slå upp molmassan för metanol och enkelt lösa uppgiften.
Tusen tack för den förklaringen. Det jag nu fortfarande inte förstår är var man hittar dessa siffror. I den formelsamling vi får ha med oss (Fysika, LTU, länk tar er direkt till nerladdning utav boken i PDF: Fysika) finner jag varken eller .
Ångbildningdsvärmen för Metanol är enligt min bok 1100*10^3 J/kg, vilket inte alls stämmer med de 35200 du skrivit ut och som är givet i många andra exempel uppgifter. Därför har jag som kört fast, för det känns som att det är en viktig siffra att ha med i beräkningen.
Du får nog titta lite mer på enheterna. Och lita lite mer på vad som står i boken.
Vilken är molmassan för metanol? Det är skillnad på om ångbildningsvärme-värdet är per mol eller per kg.
Ångbildningsvärmen angav du på 35.2 kJ/mol.
I alla liknande exempel på engelska kallar dem för , (tror jag) och har den alltid given till typ 35.2 KJ/mol.
Tänk på att den du skrev nu är J/kg och den jag skrev är (som du också skrev i ditt inlägg) J/mol.
Ångbildningdsvärmen för Metanol är enligt min bok 1100*10^3 J/kg, vilket inte alls stämmer med de 35200 du skrivit ut och som är givet i många andra exempel uppgifter.
Du kan hitta den på massvis av ställen. Kolla artiklar på sciencedirect till exempel:
https://www.sciencedirect.com/topics/chemistry/entropy-of-vaporization
Hursomhelst, oavsett vilken man använder gäller relationen:
Ebola skrev:Ångbildningsvärmen angav du på 35.2 kJ/mol.
I alla liknande exempel på engelska kallar dem för , (tror jag) och har den alltid given till typ 35.2 KJ/mol.
Tänk på att den du skrev nu är J/kg och den jag skrev är (som du också skrev i ditt inlägg) J/mol.
Ångbildningdsvärmen för Metanol är enligt min bok 1100*10^3 J/kg, vilket inte alls stämmer med de 35200 du skrivit ut och som är givet i många andra exempel uppgifter.
Du kan hitta den på massvis av ställen. Kolla artiklar på sciencedirect till exempel:
https://www.sciencedirect.com/topics/chemistry/entropy-of-vaporization
Hursomhelst, oavsett vilken man använder gäller relationen:
Ångbildningsvärmen ligger på 110 kJ som du också angett i din lösning, 35.2 kJ/mol (det som brukar kallas står alltid givet i andra liknande uppgifter, hittar inte det nånstans i min bok (som är det enda vi får använda)
Har inte stenkoll på enhetsbeteckningarna inom termodynamiken så ska tänka efter extra när det är tentadags!
Men iaf, tusen tack för att du löste uppgiften! Det är alltså enbart ett Q som skall användas, och det är för fasövergången. Jag tänkte att man skulle addera flera Q och tjorva, men antar att det räcker med fasövergångens värmemängd.
Löste nu uppgiften genom att göra såhär:
Smaragdalena skrev:Vilken är molmassan för metanol? Det är skillnad på om ångbildningsvärme-värdet är per mol eller per kg.
I min bok är det angivet J/kg, gissar att jag sett ångbildningsvärmen angiven i J/mol utan att tänka på det!