Fysik 2 atomkärnans-nivåer, spektrum
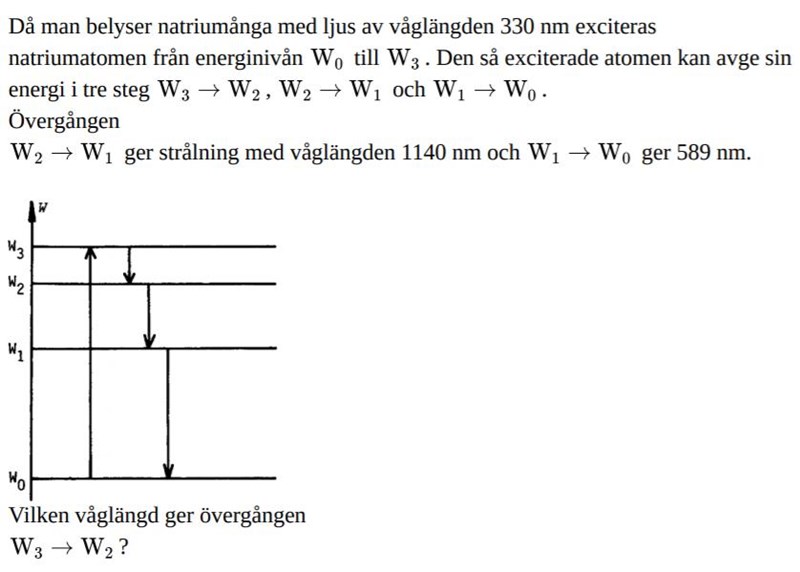
jag har räknat ut elektronvolten samt i Joule, det enda jag har problem med är sista delen hur man får ut våglängden w3 ---> w2, samt joulen /ev innan dess jag kan få ut våglängden, vad är det jag missar? hur ska jag tänka angående nivåerna någon som har en bra förklaring,
de värden jag har fått ut är, w0 --> w3 = 3.76 ev samt 1,746*10^-19 J
w1 --> w0 är 2,10 ev --> 3,375*10^-19 J
samt w2 ---> w1 = 1,088 ev , 6,02*10^-19 J
tack på förhand
mvh Oskar
Du gör fel när du omvandlar eV till J. Istället för att minska ökar dina tal.
Energin = h x frekvens = h x c / våglängd
ok,
så är det W1 --> W0 är -2,10 ev ---> 3,37*10^-19 j
w2 --> w1= -1,088 ev är 1,746*10^-19 j
w0 ---> w3 = 3,76 ev , excitation, 6,02*10^-19 j
hur fortsätter jag
för att få ut w3-w2 joulen/ ev, det är här jag har fastnat.
jag förstår för att få ut våglängden använder man E=h*f = hc/lambda, jag letar inte efter svaret utan en del av beräkningen för få ut w3---> w2 så jag kan fortsätta göra sista delen för att få ut våglängden,
är det så att man använder 3,76 ev - (-1,088) ev, för att få ut ev och sedan omvandla till J.
jag räknar i Joule
w0 - w3 ger 6,03 10-19 J
w0 - w1 ger 3,38 10-19 J
w1 - w2 ger 1,75 10-19 J
då fixar du w2 - w3
ser nu att dina siffror är samma men ihopblandade
jag subtraherar alla energier, får ut 9,0*10^-20 J , därefter använder jag lambda = hc/ 9,0*10^-20 m = 2,20*10^-6 m alltså är lambda = 2,20 mikrometer,
är detta rätt tänk och kan du möjligtvis förklara hur jag tyder figuren.
Det är rätt!
Ljus av våglängden 330 nm belyser en natriumatom. Då exciteras en elektron från W0 till ett högre energitillstånd längre från atomkärnan W3. Lite längre upp är elektronen helt fri.
Elektronen vill hamna i sitt lägsta energitillstånd (lägsta potentiella energi) som är W0. Då kan det ske stegvis via W2 och därefter till W1 och sedan till W0. Varje gång avges energin i form av en foton som motsvarar energiskillnaden mellan elektronnivåerna.

