galvanisering av järn med Zinc
här nar man galvaniserar järn med zinc gör man så
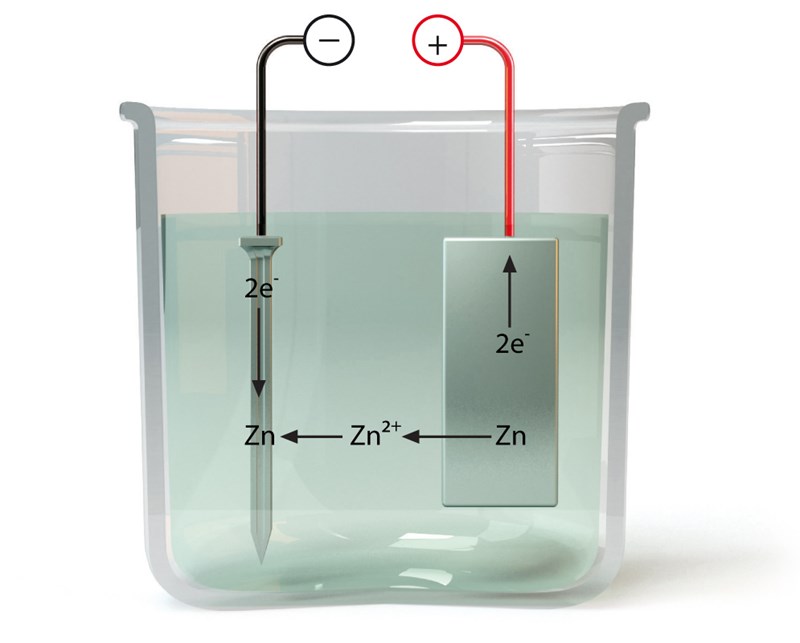 alltså anod är Fe
alltså anod är Fe
katod är Zn
och elektrolyt är lösning av Zinc sulfat alltså joner av zinc och sulfat
när strömmen är på kan den järnelektrod- anod får en överskött av elektroner och - laddning. det gör att dem drar + laddade zinc joner så när de zinc joner når nära anod får dem 2 elektroner och blir till zinc atom så får den järn en zinc beläggning
så det är från lösningen - elektrolyt det zinc jonerna kommer ifrån så varför har man en zink plåt i katod som skapar zinc joner ? kan man inte ha katod i en annan metall som leder ström bra ex grafit ?
MVH
Du har kastat om elektroderna - det är anoden som består av zink. Anledningen till att man använder det istället för grafit är att anoden löses upp om man använder zink, vilket gör att elektrolytens koncentration är konstant. Med en grafitanod skulle man även få syrgasutveckling och det kan fräta upp grafitelektroder.
är inte anod - pol ( järn ) och katod + pol ( Zn)?
Nej. Vid elektrolys är det tvärt om. Det finns en minnesregel vid elektrolys som kallas för PANK - Positiv Anod, Negativ Katod.
okej nu förstår jag
tack så mycket



