Galvanisk cell
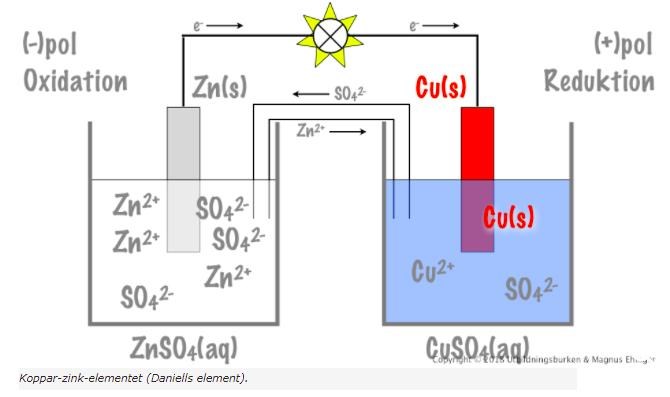
Hej jag är lite förvirrad över det här galvaniska elementet. För det första undrar jag vad kopparelektroden fyller för funktion, det är ju kopparjonerna i elektrolytlösningen som tar upp elektronerna från ledningen...
Sen undrar jag också hur elektrodernas massor förändras när elementet ger ström. Mitt antagande är att zinkelektrodens massa minskar (eftersom zink oxideras) och att kopparelektrodens massa ökar (de fria kopparjonerna i elektrolytlösningen reduceras till fast koppar som lägger sig som en beläggning runt kopparelektroden, vilket ökar kopparelektrodens vikt). Rätta mig gärna
När du tillför ström kommer elektronerna strömma från minuspol till pluspol (även om man säger att ström går från plus till minus). Det här betyder i sin tur att zinkelektroden oxideras, precis som du säger, och förlorar därmed elektroner. Denna reaktion sker:
ox: Zn(s)-> Zn2+(aq) + 2e-
red: Cu2+(aq) + 2e- -> Cu(s)
Kopparjonerna reduceras och bildar fast koppar.
Dvs, zinkelektroden är det galvaniska elementets minuspol, som alltså tillför elektroner som kan strömma till pluspolen
Själva kopparbiten har bara som uppgift att leda ner elektronerna i den högra halvcellen. Man hade inte kunnat använda en metall som var mindre ädel än koppar eftersom den då hade reagerat med kopparjonerna direkt istället.


