Halogenerna
Hej! Finns det någon anledning till att halogenerna består av tvåatomiga molekyler? Varför förekommer de inte som enskilda atomer?
Så som jag har förstått det så är det för att atomerna vill uppnå ädegasstruktur.
men när jag får förklarat för mig varför till exempel syre binder till varandra så får jag oftast se en sådan här bild:
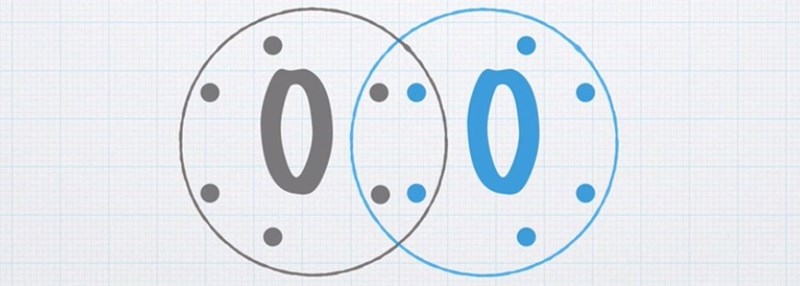 Jag förstår inte riktigt hur bilden visar att det kretar 8 elektroner kring det yttersta elektronskalet. Hur binder sig de 4 elektronerna mellan elektronskalen och fördelar sig jämt mellan syreatomerna?
Jag förstår inte riktigt hur bilden visar att det kretar 8 elektroner kring det yttersta elektronskalet. Hur binder sig de 4 elektronerna mellan elektronskalen och fördelar sig jämt mellan syreatomerna?
Du ska inte tänka att elektronerna kretsar kring atomkärnorna som planeterna kretsar kring solen, det är en felaktig bild. Du ska snarare se det som att elektronerna som är inringade i figuren kan anses höra till just den atomen. Eftersom det finns åtta elektroner runt varje atom så uppnår bägge atomerna ädelgasstruktur. Det är det som är anledningen till att atomerna sitt ihop två och två. Om halogenernas atomer vore ensamma skulle de bara ha sju valenselektroner vardera. Atomerna i syres grupp (kalkogenerna) skulle bara ha sex valenselektroner.
Teraeagle skrev:Du ska inte tänka att elektronerna kretsar kring atomkärnorna som planeterna kretsar kring solen, det är en felaktig bild. Du ska snarare se det som att elektronerna som är inringade i figuren kan anses höra till just den atomen. Eftersom det finns åtta elektroner runt varje atom så uppnår bägge atomerna ädelgasstruktur. Det är det som är anledningen till att atomerna sitt ihop två och två. Om halogenernas atomer vore ensamma skulle de bara ha sju valenselektroner vardera. Atomerna i syres grupp (kalkogenerna) skulle bara ha sex valenselektroner.
ok. tack så mycket! känner att jag fick en bättre bild av vad det faktiskt är. Finns det något sätt att tänka på om jag får en fråga på ett prov där jag ska rita upp molekylföreningen av kväve till exempel? hur ska jag veta hur många elektronpar som bildas, eller är det något som man lär sig utan till?
För de atomslag där man kan tänka sig att man frågar om detta på gymnasienivå: Hur många elektroner behöver vardera atomen låna för att få ihop 8 elektroner i sitt yttersta skal?
Smaragdalena skrev:För de atomslag där man kan tänka sig att man frågar om detta på gymnasienivå: Hur många elektroner behöver vardera atomen låna för att få ihop 8 elektroner i sitt yttersta skal?
Kolatomen (till exempel) behöver 4 elektroner för att få 8 valenselektroner.
Hur ska jag tänka här tillexempel?
den kan väll binda till 4 väteatomer, och då få 4 elektronpar? Eller 2 syreatomer, Och få två elektronpar?
Det stämmer att syre behöver låna två elektroner så där skulle man förvänta sig två bindande elektronpar (dubbelbindning). Kväve saknar tre elektroner så där skulle man förvänta sig tre bindande elektronpar (trippelbindning).
När det kommer till kol är situationen lite krångligare. Det går nämligen inte att ha fyra bindande elektronpar eftersom bindningsvinklarna inte tillåter det. Lite svårt att förklara varför det blir så på grundskolenivå, men du kan tänka dig att elektronerna som skulle bilda det fjärde paret finns längst ut på molekylernas ”ytterkanter” så de kan inte komma nära och binda till varandra. Om det finns en molekylbyggsats på din skola kan du testa att bygga en sådan kolmolekyl så ser du att det inte går.
I verkligheten binder kol i sitt rena tillstånd till varandra med olika typer av enkelbindningar i diamant, grafit, fulleren och grafen.
Teraeagle skrev:Det stämmer att syre behöver låna två elektroner så där skulle man förvänta sig två bindande elektronpar (dubbelbindning). Kväve saknar tre elektroner så där skulle man förvänta sig tre bindande elektronpar (trippelbindning).
När det kommer till kol är situationen lite krångligare. Det går nämligen inte att ha fyra bindande elektronpar eftersom bindningsvinklarna inte tillåter det. Lite svårt att förklara varför det blir så på grundskolenivå, men du kan tänka dig att elektronerna som skulle bilda det fjärde paret finns längst ut på molekylernas ”ytterkanter” så de kan inte komma nära och binda till varandra. Om det finns en molekylbyggsats på din skola kan du testa att bygga en sådan kolmolekyl så ser du att det inte går.
I verkligheten binder kol i sitt rena tillstånd till varandra med olika typer av enkelbindningar i diamant, grafit, fulleren och grafen.
men är det inte just det som händer i metan? att 4 väteatomer binder till en kolatom för att uppnå ädelgasstruktur?
Jo, men då är det fyra enkelbindningar (en från vardera väteatom till kolatomen). Det jag menar är att det inte kan finnas fyra bindningar mellan två atomer.




