HJÄLP FORT KEMI - Ekvivalenspunkt - Koncentration - Titrering
Vi har fått ett övningsprov (gammalt prov) i Kemi men inget facit till det, och eftersom jag kommit efter i kemi vet jag inte hur jag ska lösa dem. Behöver akut akut akut hjälp med detta tills imorgon, om du hjälper mig är du en ängel :'( vet inte vad jag annars kan göra det finns ingen annan att fråga.
Först fick vi en labb lapp där det stod
Syrabastitrering Syfte:
Bestäm koncentrationen för en ammoniaklösning
Bakgrund: När man titrerar tillsätter man ett ämne till ett annat med hjälp av en byrett. I den här titreringen ska du bestämma koncentrationen av en vattenlösning av en svag bas (NH3) genom att tillsätta saltsyralösning (HCI) droppvis till ammoniaklösningen. Med hjälp av en pH-meter bestäms pH. Sedan avsätts pH-värdet mot tillsatt mängd saltsyra i ett diagram - man får då en så kallad titrerkurva. Med hjälp av denna kurva lokaliseras ekvivalenspunkten, d v s den punkt då man tillsatt lika stor substansmängd syra som substansmängden bas i den ursprungliga lösningen. Sedan kan koncentrationen av ammoniak bestämmas.
Kemikalier och materiel: NH3(aq) okänd konc., HCI(aq) 0,10 mol/dm', vollpipett 10 cm', byrett 25 cm', tratt, bägare 200 cm', magnetomrörare och magnet, pH-meter (kalibrera), slaskbägare, stativ.
DESSA FRÅGOR:
Ke 2 Övningsprov om Syra-bas-titrering
Tex LAB: Din uppgift var att bestämma koncentrationen på en ammoniaklösning med hjälp av en saltsyralösning med koncentrationen 0,10 mol/dm3.
E-kvalitets-frågor
1. Skriv reaktionsformeln för reaktionen som sker vid titreringen. 1/0/0
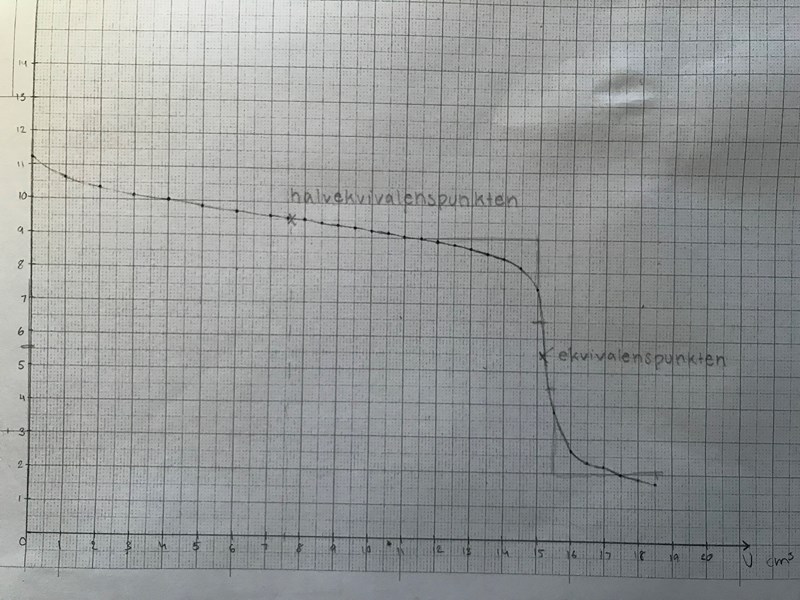
2. Markera ekvivalenspunkten på din titrerkurva och läs av pH. 1/0/0 Gjort denna pH= 5,5 V= 15,2 cm3 Är det rätt?
3. Varför är pH inte är neutralt, d v s 7, i ekvivalenspunkten? Förklara med ord och reaktionsformel. 1/1/0
4. Beräkna koncentrationen för ammoniaklösningen. Redovisa din lösning. 3/0/0
5. Markera halvtitrerpunkten i diagrammet. 1/0/0 Gjort denna pH= 9,5 V= 7,6 cm3 rätt?
6. När fungerar lösningen bäst som buffertlösning? Motivera noggrant. 1/1/0
C-kvalitets-frågor
7. Använd det pH-värde du mätte upp på lab innan extra vatten tillsattes och bestäm ammoniakens koncentration. 0/3/0
8. Hur är det möjligt att vi kan tillsätta vatten innan vi börjar själva titreringen utan att det påverkar beräkningen av koncentrationen? 0/1/0
9. Beräkna Kb med hjälp av halvtitrerpunkten. Redovisa noggrant. 0/2/0
10. Utgå från din beräknade koncentration på NH3 och beräkna vad pH borde ha blivit i ekvivalenspunkten. 0/3/1
A-kvalitets-frågor (här är ordgränsen 200 ord/svar)
11. I er laboration använde ni pH-elektrod för att bestämma pH i varje punkt. I syra-bas- titreringar kan man även använda indikatorer. Vad för egenskap måste en syra-bas- indikator ha för att kunna fungera som just en indikator. Motivera noggrant 0/1/1
12. Varför är det så brant runt ekvivalenspunkten? 0/0/1
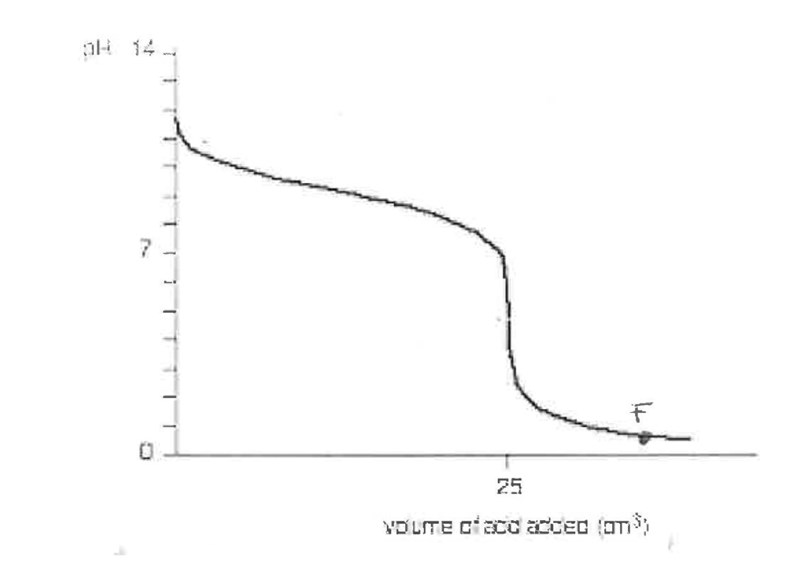
13. Är lösningen en buffert i punkt F (se figur nedan)? Motivera ditt svar genom att resonera kring hur en buffert fungerar. 0/1/1
14. Syra-bas-titrering är en metod för att kvantifiera en syras eller bas koncentration men...
a) Behöver man egentligen titrera för det? Motivera noggrant. 0/0/1
b) Vilken information får man ut av er titrerkurva? Vad skulle man generellt kunna använda denna metod (titrering med titrerkurva) till rent kvalitativt? Motivera noggrant. 0/1/1
Välkommen till Pluggakuten! Vi hjälper dig gärna, men då måste du följa Pluggakutens regler. Jag låter denna tråd. Du är varmt välkommen att skapa nya trådar där du:
- Visar hur du har försökt.
- Endast skriver en fråga per tråd.
- Undviker att använda caps lock och ord som "Hjälp" och "Fort" i rubriken.
// Smutstvätt, moderator


