HOMO och LUMO --> att förstå vad som sker i en reaktion
Okej så en reaktion sker om en nukleofils HOMO-orbital inte ligger för långt från en molekyl-i-närheten's LUMO-orbital (antingen "naturligt", tex genom att nukleofilen är en stark laddad bas som OH-, eller genom att LUMO sänks (förstår dock inte hur det kan ske men tänker bara på vad vi gått igenom om där följande nämnts:) genom aktivering tex genom protonering på syret i en karbonylgrupp).
MEN
Hur ska jag veta vilka molekylers molekylorbitaler (eller är det atomers atomorbitaler? för är det inte O:et tex som attackerar med fria elektronpar i OH-??) som är höga HOMO
och
hur ska man veta vilka molekyler som har låga LUMOs?
MO i HOMO och LUMO står för MolekylOrbital, så det är inte atomorbitalerna som är aktuella.
Jag skulle säga att Quacker är på rätt spår!
Eller ja, alltså, ska man vara riktigt noggrann är molekylorbitaler rätt så komplicerade varelser (se t.ex. MO-diagrammet för vatten på Wikipedia), men så länge man inte håller på med alltför komplicerade pi-system och sånt så kommer man väldigt långt inom den organiska kemin med ett rätt så förenklat förhållaningssett, där man låtsas att molekylorbitalerna består dels av bindningsorbtitalerna för varje bindning (sigma, sigma* eller pi och pi*) samt oanvända (hybrid)atomorbitaler.
För vatten skulle jag till exempel säga att de intressanta molekylorbitalerna är dessa:
- Två tomma sigma*-obritaler för O-H-bindningarna (LUMO!)
- Två fulla sp3-orbitaler på syret (HOMO!)
- Två sigma-orbitaler för O-H-bindningen.
(Det finns även massa tomma oanvända atomorbitaler på syrena respektive vätet, men dessa är på så höga nivåer att de knappast är speciellt relevanta för reaktionen.)
Låter detta vettigt?
Hur högt eller lågt olika molekylobritaler sen ligger är komplicerat. Generellt kan man tänka att atomorbitaler ligger lågt om de ligger nära en starkt plusladdad och oskärmad kärna (tänk effektiv kärnladdning och elektronegativitet). Man kan också tänka att starka bindningar ger låga bindande och och höga antibindande orbitaler. Men exakt hur orbitalerna ligger är svårt att bara resonera sig fram till, utan ofta får man nöja sig med lite spekulationer fram och tillbaka -- eller så man ge sig på att göra (ofta ganska komplicerade) teoretiska beräkningar eller experiment.
Säg gärna till om det är något specifikt exempel du är fundersam över, så kan jag eller någon annan här se om vi kan säga något vettigt om hur man kan resonera!
Sidenote: Vill du lära dig bättre modeller för hur molekylorbitaler ser ut, och hur man kan beräkna deras energinivåer rekommenderar jag att du provar att läsa någon kurs i fysikalisk kemi (mer specifikt kvantkemi) om det finns i ditt kursutbud! Väldigt spännande saker, och det dyker upp massa intressant matematik! :D
Tack!
Jag får fundera lite innan jag frågar mer men har en fråga nu:
Tex i bilden nedan, syrakatalyserad epoxidöppning, så agerar dubbelbindningen nukleofil (egentligen på 2 ställen men syftar just nu på den närmast ringen). Hur vet man att dubbelbindningen är den som attackerar och inte den som H+ kommer ifrån - vilken ju (om jag inte missförstått!) antingen är vattnet som blivit protonerat av en syra - eller är direkt från en syra om epoxiden är löst i en syra (vet inte om man faktiskt KAN lösa en epoxid i en syra men tänker vad som H+ KAN komma ifrån). För tex i bokens mekanism för syrakatalyserad epoxidöppning är det vatten istället som attackerar där dubbelbindningen attackerar på epoxidringen - så varför är det inte anjonen till H+/vatten som gör det här och hur vet jag detta?
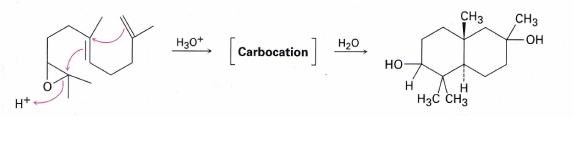
Bra tankar! Det är en rätt stökig reaktion detta, med flera tänkbara alternativa produkter, och jag sitter verkligen inte inne på några definitiva svar här. Kolla därför gärna med din lärare också, och återkom om hen ser detta på något annat sätt!
Men i princip är detta ju, precis som du är inne på, en vanlig epoxidöppning under sura betingelser; syran protonerar epoxiden så att den öppnar sig och bildar en karbokatjon, och karbokatjonen reagerar sedan vidare med en nukleofil, som i detta fallet är vattnet.
Det som är speciellt här är att karbokatjonen "byter skepnad" innan den reagerar med vattnet. Att karbokatjoner i stora molekyler kan hitta på sådana tokigheter, och omlagras till stabilare varianter, är egentligen ganska vanligt (även om detta är ett ovanligt spektakulärt exempel), och kan vara ett stort problem för syntetiska kemister. Se här för fler exempel (kolla särskilt på det smått legendariska exemplet med kolesterol där reaktionen du frågar om är en viktig pusselbit!).
Alltsomallt har vi ett litet nätverk av reversibla reaktioner där olika varianter av karbokatjonen står i jämvikt med varandra, så här:
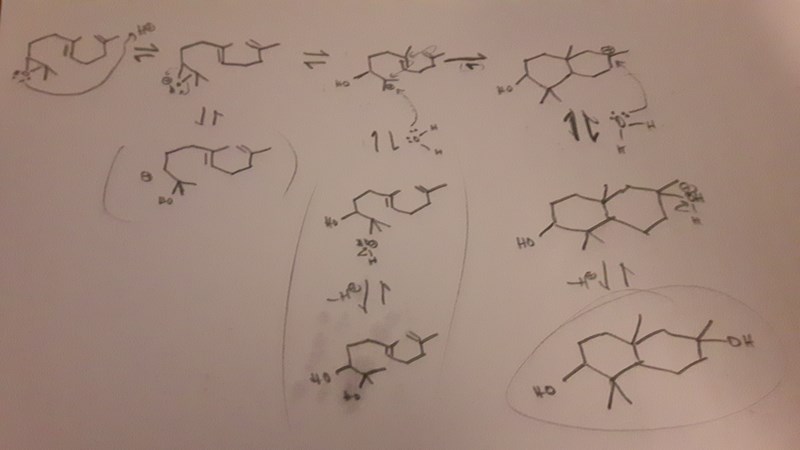
Och i princip kan vilken som helst av de här varianterna reagera vidare med vattnet! Dessutom kan vattnet under sura betingelser lossna så att vi får tillbaka karbokatjonen. Så det är inte alls helt uppenbart vad slutprodukten blir...
Men det jag tror händer är att ringslutningen egentligen inte är så värst reversibel, utan när ringarna väl har bildats så har det mycket svårt att brytas upp igen. Man kan resonera i termer av Gibbs fria energi om man vill. Visserligen sker det en entropiförlust när vi går från en flexibel kedja till en mer rigid ringstruktur men eftersom sigma-bindningar är mycket starkare än pi-bindningar tror jag att vi i slutändan får en så stor frigörelse av entalpi att Gibbs fria energi blir starkt negativ, vilket betyser att jämviktskonstanten är mycket större än 1. (Men för att vara säker på detta måste man göra experiment och/eller datorberäkningar.)
Till slut kommer därför nästan alla karbokatjoner föreligga i ringformen, och när produkten upparbetas så kommer man nästan bara få produkten som din figur anger.
[Sidenote: Notera att HOMO/LUMO, som din ursprungsfråga handlade om, inte spelar någon större roll här, eftersom orbitalöverlapp främst påverkar reaktionshastighet. Här handlar det i stället om jämvikter och stabilitet. Även om ringbildningen är långsam kan den så att säga "vinna" över de andra alternativen om alla andra reaktioner är reversibla.]
Men, okej, då var det också det här med vilken nukleofil som gör den slutgiltiga attacken. Jag håller med om att det inte är självklart att det blir vattnet. Som bekant är ju vatten inte någon superbra nukleofil (även om detta delvis uppvägs av att det finns oerhört många vattenmolekyler i närheten av molekylen om det används som lösningsmedel). Om syran som används har en korresponderande bas som råkar vara en stark nukleofil (tänk HI eller någon annan vätehalid), skulle man kunna få något i stil med nedanstående figur. Detta gäller i synnerhet om man helt undviker vatten som lösningsmedel, och i stället kör på något helt icke-nukleofilt.
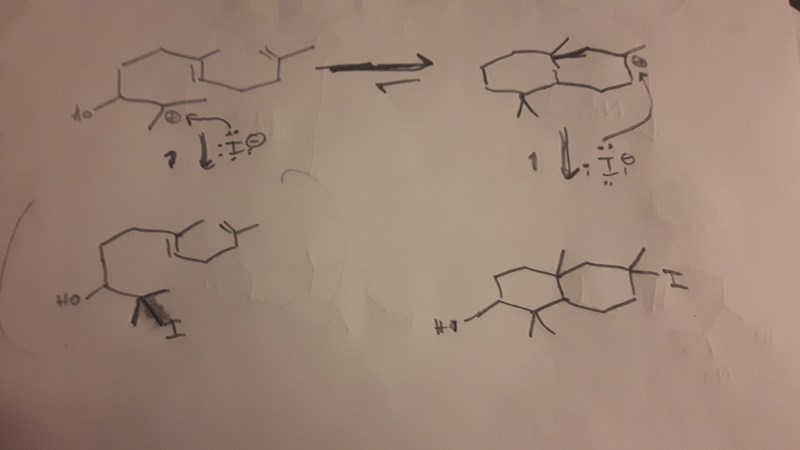
I det här fallet är det så vitt jag kan se inte heller självklart längre att själva den nukleofila attacken blir reversibel, vilket betyder att reaktionshastighet kan bli en faktor, och då skulle eventuellt den cykliska produkten kunna bli utkonkurrerad av något snabbare (om än mindre gynnsamt) alternativ.
Om den cykliska alkoholprodukten är målet är det nog säkrast att köra på vatten som lösningsmedel och en syrakatalysator vars korresponderande bas verkligen är erkänt kass som nukleofil, t.ex. svavelsyra.
Var detta svar på dina frågor? Annars är det bara att säga till, så försöker vi gärna reda ut det bättre!



