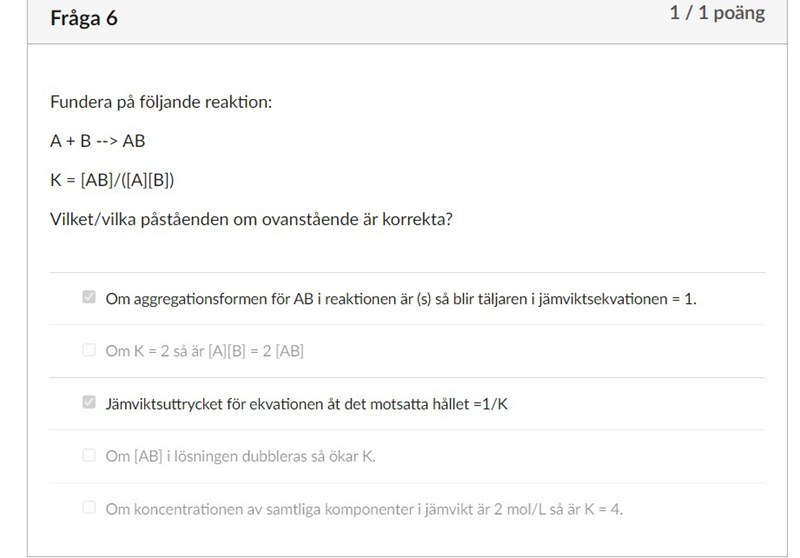
Hur kan aggregationstillståndet påverka koncentrationen?
Hej,
Jag har gjort ett quiz flera gånger och gissat mig fram till rätt svar.
Jag förstår inte hur påståendet "Om aggregationstillståndet för AB i reaktionen är (s) så blir täljaren i jämviktsekvationen = 1". Hur kan aggregationstillståndet för AB påverka koncentrationen av AB?
Koncentrationen för ett rent, fast ämne är konstant, är du med på detta?
Jag förstår inte detta riktigt.
Jag vet att vid kemisk jämvikt och när lösningar är mättade förändras inte koncentrationerna av lösta ämnen i lösningsmedlet.
Om man till exempel löser salt i ett glas med vatten och häller i mer salt i glaset, så kommer ju lösningen till slut att bli mättad och då kommer inte mer salt att lösa sig i vatten, men då ökar ju koncentrationen av det fasta ämnet i glaset?
Så, nej, jag förstår inte varför koncentrationen av ett fast ämne är konstant.
Det här är lite lurigt eftersom det hänger ihop med begreppet aktivitet som man inte tar upp i gymnasiekemin. Man får oftast bara acceptera att koncentrationen sätts till "1" i jämviktsekvationer utan någon riktig förklaring. Egentligen ska jämviktsekvationen se ut såhär:
Där {ämne} betecknar ämnets aktivitet, vilket kan liknas vid ett sorts effektiv koncentration. Om koncentrationen är 1 mol/dm3 skulle lösningen kanske bete sig som om koncentrationen egentligen vore 0,8 mol/dm3 när man gör mätningar av den och då säger man att aktiviteten är 0,8. För väldigt utspädda lösningar är aktiviteten i stort sett lika hög som koncentrationen, dvs en lösning med koncentrationen 0,01 mol/dm3 kommer att bete sig som en lösning med koncentrationen 0,01 mol/dm3. Därför brukar man förenkla på gymnasiet och ersätta aktiviteter med koncentrationer (inom universitetskemin räknar man istället med aktivitet).
Hur spelar då detta in på fasta ämnen? Jo, till att börja med kan man notera att aktiviteter är enhetslösa medan koncentrationer har en enhet (mol/dm3). Aktiviteten beräknas enligt:
där står för ämnets aktivitetskoefficient medan står för ämnets koncentration vid standardtillstånd. För rena ämnen gäller att .
Det är här som Smaragdalenas påpekande om att koncentrationen för ett rent fast ämne alltid är konstant kommer in i bilden. Det spelar ingen roll hur mycket av ett fast ämne vi har, för dess koncentration är alltid likadan. Om man har svårt att greppa detta kan man tänka på densiteten istället. Det spelar ingen roll t.ex. hur mycket järn man har, för densiteten för järn är alltid likadan, eller hur? Det säger att det alltid finns lika många järnatomer per volymenhet, dvs koncentrationen för järn är också alltid likadan. Det får till följd att vilket då ger att . Detta förenklar man sedan i gymnasiekemin och säger att .
Jag tänker att man "bakar in" koncentrationen för det fasta ämnet i jänviktskonstanten.
Hej,
Tack Teraeagle för din utförliga förklaring!
Jag förstår dock inte hur man ska "baka in" koncentrationen för fasta ämnet i jämviktskonstanten? Menar du att eftersom koncentrationen av fasta ämnen är 1, så ska man ha 1 i jämviktsekvationen?
Det funkar att ”baka in” koncentrationen i jämviktskonstanten så länge man inte använder sig av en termodynamisk jämviktskonstant. Det som menas då är att man konstaterar att koncentrationen av ett fast ämne i sig är en konstant. Då kan man ersätta den ”gamla” jämviktskonstanten med en ”ny” som även innefattar den gamla konstanten. I detta fall skulle den nya konstanten vara K/[AB].
Tack så mycket för hjälpen! Ni förklarade jättebra!



