Hur kan protein uttryckas efter SDS-PAGE?
SDS (sodium dodecyl sulphate) används väl vid gelelektrofores tillsammans med polyakrylamid-gel. När man söker på SDS så står det att det denaturerar proteinerna och binder till vissa aminosyror (vilket jag fattat det som är en förutsättning för att gelelektrofores ska fungera med proteiner). Om SDS denaturerar proteiner, hur kan då proteinerna uttryckas efter gelelektrofores (exempelvis GFP)? När vi utförde gelelektrofores med GFP så värme vi upp ett provrör med GFP och ett annat fick vara som det var. Det som var uppvärmt hade tappat sin fluorescerande förmåga, medan det icke-uppvärmda fortfarande var fluorescerande (vilket syntes efter gelelektroforesen när vi lyste med UV-ljus). Det jag undrar är helt enkelt är hur detta fungerar om SDS är denaturerande?
sund20 skrev:SDS (sodium dodecyl sulphate) används väl vid gelelektrofores tillsammans med polyakrylamid-gel. När man söker på SDS så står det att det denaturerar proteinerna och binder till vissa aminosyror (vilket jag fattat det som är en förutsättning för att gelelektrofores ska fungera med proteiner).
SDS binder in i proteinet och kan börjar smälta proteinets struktur. Vid PAGE används även det faktum att SDS är negativt laddat, och då det binder in till alla proteiner får de samtliga en stark negativ laddning - så de allihopa kommer röra sig mot pluspolen tillsammans. Attraktionskraften mot den positiva polen blir likvärdig för proteinerna, och separationen bli då efter proteinernas storlek, där de större bromsas oftare i gelen än de mindre (där de mindre då rör sig snabbare och längre i gelen). Utan SDS skulle proteinernas olika isoelektriska punkt göra att de hade olika laddning, och de skulle röra sig olika snabbt beroende på deras laddning, och inte beroende på sin storlek (ett stort protein med hög laddning skulle t.ex. röra sig mycket snabbare än ett litet med låg eller ingen laddning).
Om SDS denaturerar proteiner, hur kan då proteinerna uttryckas efter gelelektrofores (exempelvis GFP)?
De uttrycks inte alls efter PAGE. Med begreppet "proteinuttryck" syftar man på att en cell producerar ett protein, alternativt att cellen på sin cellyta uttrycker (d.v.s. "visar upp") ett protein för sin omgivning. Du kanske menar att t.ex. GFP kan visualiseras/detekteras (d.v.s. ses) efter PAGE?
När du gör PAGE är oftast proteinet denaturerat, efter tillsats av SDS och oftast upphettning (t.ex. 5 minuter vid 95°C).
När vi utförde gelelektrofores med GFP så värme vi upp ett provrör med GFP och ett annat fick vara som det var. Det som var uppvärmt hade tappat sin fluorescerande förmåga, medan det icke-uppvärmda fortfarande var fluorescerande (vilket syntes efter gelelektroforesen när vi lyste med UV-ljus). Det jag undrar är helt enkelt är hur detta fungerar om SDS är denaturerande?
Proteiners stabilitet är individuell, vissa är väldigt känsliga och denaturerar lätt, medans andra är mycket stabila och tål otrevliga omständigheter. Vid t.ex. PCR hettas DNA-polymeraset upp till 95°C i omgångar, upp till en halv timme! De flesta proteiner denaturerar mycket tidigare (våra oftast redan innan 50°C). Men de DNA-polymeras som används vid PCR kommer ifrån termofiler (mikroorganismer som lever vid heta källor och de är vana vid kokande vatten), så 95°C är inget problem för just dessa proteiner.
Så vissa proteiner tål väldigt lite SDS, en del mer. GFP-klarar en del SDS, i alla fall så mycket som krävs för att ge alla proteiner laddning och kunna separera dem med PAGE, så låter du bli att koka GFP går det att tillsätta lite SDS och köra det på en PAGE.
Det är inte ovanligt att köra en så kallad nativ PAGE (där proverna inte hettas upp och därför har kvar sin struktur) med lite SDS eller ett liknande ämne som ger proteinerna laddning. Sedan separeras proteinerna med sin struktur intakt under PAGE och kan visualiseras eller till och med tas ut ur gelen aningen renare.
mag1 skrev:sund20 skrev:SDS (sodium dodecyl sulphate) används väl vid gelelektrofores tillsammans med polyakrylamid-gel. När man söker på SDS så står det att det denaturerar proteinerna och binder till vissa aminosyror (vilket jag fattat det som är en förutsättning för att gelelektrofores ska fungera med proteiner).
SDS binder in i proteinet och kan börjar smälta proteinets struktur. Vid PAGE används även det faktum att SDS är negativt laddat, och då det binder in till alla proteiner får de samtliga en stark negativ laddning - så de allihopa kommer röra sig mot pluspolen tillsammans. Attraktionskraften mot den positiva polen blir likvärdig för proteinerna, och separationen bli då efter proteinernas storlek, där de större bromsas oftare i gelen än de mindre (där de mindre då rör sig snabbare och längre i gelen). Utan SDS skulle proteinernas olika isoelektriska punkt göra att de hade olika laddning, och de skulle röra sig olika snabbt beroende på deras laddning, och inte beroende på sin storlek (ett stort protein med hög laddning skulle t.ex. röra sig mycket snabbare än ett litet med låg eller ingen laddning).
Om SDS denaturerar proteiner, hur kan då proteinerna uttryckas efter gelelektrofores (exempelvis GFP)?
De uttrycks inte alls efter PAGE. Med begreppet "proteinuttryck" syftar man på att en cell producerar ett protein, alternativt att cellen på sin cellyta uttrycker (d.v.s. "visar upp") ett protein för sin omgivning. Du kanske menar att t.ex. GFP kan visualiseras/detekteras (d.v.s. ses) efter PAGE?
När du gör PAGE är oftast proteinet denaturerat, efter tillsats av SDS och oftast upphettning (t.ex. 5 minuter vid 95°C).
När vi utförde gelelektrofores med GFP så värme vi upp ett provrör med GFP och ett annat fick vara som det var. Det som var uppvärmt hade tappat sin fluorescerande förmåga, medan det icke-uppvärmda fortfarande var fluorescerande (vilket syntes efter gelelektroforesen när vi lyste med UV-ljus). Det jag undrar är helt enkelt är hur detta fungerar om SDS är denaturerande?
Proteiners stabilitet är individuell, vissa är väldigt känsliga och denaturerar lätt, medans andra är mycket stabila och tål otrevliga omständigheter. Vid t.ex. PCR hettas DNA-polymeraset upp till 95°C i omgångar, upp till en halv timme! De flesta proteiner denaturerar mycket tidigare (våra oftast redan innan 50°C). Men de DNA-polymeras som används vid PCR kommer ifrån termofiler (mikroorganismer som lever vid heta källor och de är vana vid kokande vatten), så 95°C är inget problem för just dessa proteiner.
Så vissa proteiner tål väldigt lite SDS, en del mer. GFP-klarar en del SDS, i alla fall så mycket som krävs för att ge alla proteiner laddning och kunna separera dem med PAGE, så låter du bli att koka GFP går det att tillsätta lite SDS och köra det på en PAGE.
Det är inte ovanligt att köra en så kallad nativ PAGE (där proverna inte hettas upp och därför har kvar sin struktur) med lite SDS eller ett liknande ämne som ger proteinerna laddning. Sedan separeras proteinerna med sin struktur intakt under PAGE och kan visualiseras eller till och med tas ut ur gelen aningen renare.
Så SDS måste inte nödvändigtvis veckla ut proteinerna (förstöra tertiärstrukturen), utan det kan ibland också endast tillsättas för att ge proteinerna en negativ laddning?
Är SDS utblandat i polyakrylamidgelen? Så proteinerna får den negativa laddningen först när de hamnar i gelen (brunnarna)?
Sedan, SDS-PAGE är väl en form av gelelektrofores. Vad är skillnaden mellan SDS-PAGE och vanlig gelelektrofores (förutom att SDS används för att ge proteinerna en negativ nettoladdning vilket inte behövs om det exempelvis är DNA eftersom det är negativt laddat)? Är det samma typ av gel eller vad är speciellt med PAGE?
Så SDS måste inte nödvändigtvis veckla ut proteinerna (förstöra tertiärstrukturen), utan det kan ibland också endast tillsättas för att ge proteinerna en negativ laddning?
Nej SDS behöver förstöra tertiärstrukturen, vid låga koncentrationer. Vid höga sker det.
Proteiner finns det av alla möjliga slag, och vissa binder gärna kolkedjor in i sin inre hydrofoba del, som den i SDS. T.ex. albumin i vårt blod binder gärna fria fettsyror, som påminner kemiskt om SDS.
Är SDS utblandat i polyakrylamidgelen? Så proteinerna får den negativa laddningen först när de hamnar i gelen (brunnarna)?
Det beror lite vad man önskar att ha. Gjuter du PAGE-geler själv väljer du om du vill ha SDS i gelen eller inte. PAGE-geler som köps saknar ofta SDS, men då SDS finns med i elektroforesbufferten kommer SDS in i gelen med proteinet.
Proteinprovet tillsätts vanligtvis en buffertlösning med SDS i, så att proteinerna binder till sig SDS och blir negativt laddade.
Sedan, SDS-PAGE är väl en form av gelelektrofores. Vad är skillnaden mellan SDS-PAGE och vanlig gelelektrofores (förutom att SDS används för att ge proteinerna en negativ nettoladdning vilket inte behövs om det exempelvis är DNA eftersom det är negativt laddat)? Är det samma typ av gel eller vad är speciellt med PAGE?
Elektrofores är en generell benämning på metoder där joner och laddade partiklar fås att röra sig i genom gel med hjälp av ett elektriskt fält.
Det finns PAGE med SDS och utan (s.k. nativ PAGE). Och även agaros elektrofores för t.ex. nukleinsyraseparation, där laddningen, som du skrev, redan finns i nukleinsyran vid neutralt pH (p.g.a. alla fosfatgrupper i fosfodiesterbindningarna).
Det går att separera proteiner och DNA med bägge typerna av geler, med PAGE är vanligast för protein och agaros för nukleinsyror.
Jag snodde denna bild från nätet, den kanske hjälper dig förstå:
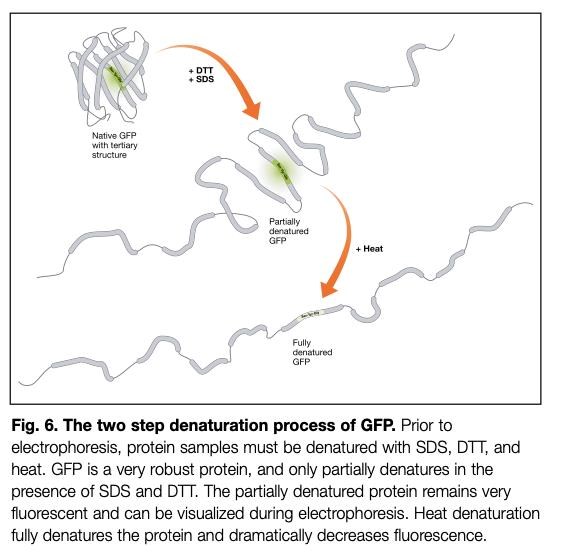
Källa: https://www.bio-rad.com/webroot/web/pdf/lse/literature/M1660023.pdf

