Hydrofoba interaktioner
hej! Jag har en fråga gällande hydrofoba interaktioner och vatten. Jag förstår att enligt 2:a termodynamikens lag så kommer ALLTID högsta oordning vilja uppnås. Därför associerarer hydrofoba molekyler med varandra och inte med vatten. 
Drivkraften bakom
Hur man menar med att de de ”hydrofoba molekylerna ”TAR BORT” vatten och att de ger drivkraft till den hydrofoba interaktionen? Hur går det till?
Maddefoppa skrev:hej! Jag har en fråga gällande hydrofoba interaktioner och vatten. Jag förstår att enligt 2:a termodynamikens lag så kommer ALLTID högsta oordning vilja uppnås. Därför associerarer hydrofoba molekyler med varandra och inte med vatten.
Drivkraften bakom
Hur man menar med att de de ”hydrofoba molekylerna ”TAR BORT” vatten och att de ger drivkraft till den hydrofoba interaktionen? Hur går det till?
Nej, nej, nej. Om man blandar vattnet med bensenet homogent, så kan det bara bli vdw-bindningar mellan molekylerna. OM vattenmolekylerna klumpar ihop sig med varandra så kommer de att bilda vätebindnigar med varandra, d v s entalpin sänks, samtidigt som entropin MINSKAR.
Hur menar du? I min bok skriver de att entropin ökar i ” HELA SYSTEMET ÖKAR” när bensen löser sig i vatten pga ”hydrofoba effekten”
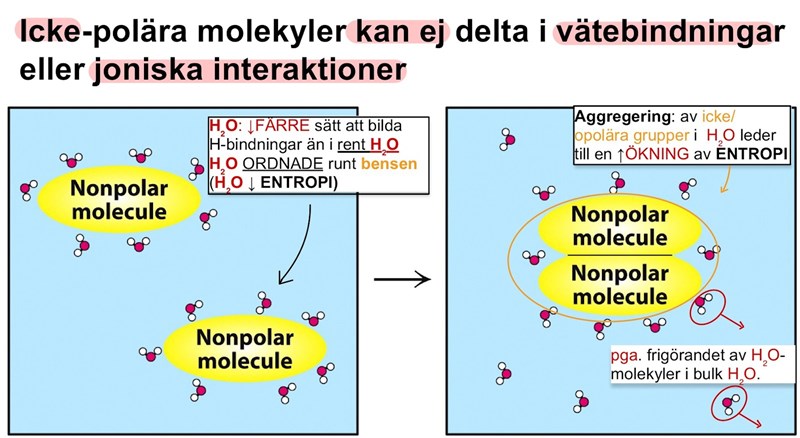
Entropin blir som lägst i H2O molekyler interagerar med varandra i bild 2.
Figur text:
”FIGURE 2.9 The hydrophobic effect. The aggregation of nonpolar groups in water leads to an increase in entropy owing to the release of water molecules into bulk water.”
Tillägg: 13 jan 2024 10:25
I fallet med bensen skriver de”
The
cavity temporarily disrupts some hydrogen
bonds between water molecules. The
displaced water molecules then reorient themselves to form the maximum number of new hydrogen bonds. However, there are many fewer ways of forming hydrogen bonds around the benzene molecule than there are in pure water. The water molecules around the benzene molecule are much more ordered than elsewhere in the solution. The introduction of the nonpolar molecule into water has resulted in a decrease in the entropy of water. Now consider the arrangement of two benzene molecules in water.They do not reside in separate small cavities (Figure 2.9A); instead, they coalesce into a single larger one (Figure 2.9B). They become organized. The energetic basis for the formation of this order is that the association of the benzene molecules releases some of the ordered water molecules around the separated benzenes, increasing the entropy of the system.
Så här förstår jag det..
✦Bensen molekyl: aromatisk kolväte.
opolär molekyl i H2O-lösning.
✦Bensen: som introduceras H2O i ”HÅLIGHET” i H2O skapas pga bensen SAKNAR polaritet → kan EJ att bilda H- bindningar med H2O- molekyler.
✦1 Bensen molekyl: SEPPARERAS H2O från & skapar en ”hålighet/tomrum” vid interaktion med H2O-molekyler.
✦Kaviteten: STÖR tillfälligt en del H- bindningar mellan H2O- molekyler.
✦Undanträngda H2O-molekyler: omorienterar sig sedan för att bilda MAXIMALT antal NYA ↑H-bindningar.
✦RUNT bensen molekyl: ↓FÄRRE sätt att bilda H- bindningar( än det finns i rent H2O.
H2O: mer ORDNADE runt bensen (H2O↓entropi)
steg 2: aggregering av 2 molekyler
✦2 bensen molekyler: som introduceras H2O bildar EJ separata ”HÅLIGHET” (bild 1) istället "gårsamman” GER mer ORDNADE inom bensen: (”bensensysystem↓entropi)
Bildningen av ordningen i bensensysystem(↓entropi): leder till att frigöra ”en del” av H2O- runt ”ENSKILDA”→H-bindningar bryts mellan bensen molekylerna- H2O. H₂O: kan maximera H-bindingar & ↑ÖKA sin entropi.
✦Entropin: H2O: bildar H-bindningar med sig själv (mer Oordnat= ↑ÖKNING entropi) & av den TOTALA entropin i systemet.
dvs gäller..
✦Opolära lösta molekyler i H2O- molekyler drivs: ihop pga när de ”associeras” FRIGÖRS H2O- molekyler (↑ÖKAR entropi i TOTOLA SYSTEMET) INTE för pga att de har opolära ämnen har ↑HÖG AFFINTET för varandra.
✦Hydrofoba effekten: Entropi driven ”association” av opolära ämnen löst i H2O-lösning→hydrofoba interaktioner.
✦Hydrofoba interaktioner: sker spontant, energi fås av från entropi ↑ÖKNING i H2O-systemet. (Hydrofoba effekten)
Det var väl länge ganska mycket debatt om detta, med många åsikter och olika modeller. Läs mer här i en äldre artikel (fr. 1999):
https://www.sciencedirect.com/science/article/abs/pii/S0301462299001052?via%3Dihub
Jämför sedan med denna moderna hantering som har ett högre termodynamiskt fokus (fr 2022):
https://www.mdpi.com/1422-0067/23/17/9811
Min rekommendation är att du söker efter information på fler ställen än din bok. Detta för att öka din känsla för hur detaljerna skiljer sig mellan olika modeller inom olika tillämpningsområden. Om det är inför en tentamen skulle jag söka diskussion med ansvarig examinator/kursansvarig snarast.