Hydrofoba interaktioner
Hej!
Enligt Magnus Ehinger är hydrofoba interaktioner inom ett protein samma sak som van der Waals-bindningar. Men jag ser ingen likhet mellan de två.
Jag tänker så här:
- Hydrofoba interaktioner sker mellan opolära sidokedjor som löser sig i varandra.
- Van der Waals-bindningar är också bindningar mellan opolära molekyler, fast detta beror på att elektroner hos molekylerna åker runt och orsakar tillfälliga dipoler med växlande minus- och pluspoler.
De hydrofoba interaktionerna, mellan sidokedjor hos icke-polära aminosyrarester, kan (bara) interagera med varandra genom just van der Walls krafter. De saknar helt enkelt möjligheten att bilda starkare bindningar (som t.ex. jon-, dipol, vätebindning). I de inre av proteiner, som inte är i kontakt med utsidan, uppstår många av dessa svagare van der Walls-interaktioner, vilka tillsammans skapar den överlag hydrofoba miljön inuti (globulära) proteiner.
Men, dessa sidokedjor är för korta och för få för att skapa en egen fas, som kan ses med t.ex. dietyleter som lägger sig ovanpå vatten vid en kemisk extraktion. Det finns med andra ord ingen möjlighet för dessa sidokedjor att "lösa sig i varandra", för det finns för många polära grupper runt omkring sidokedjorna.
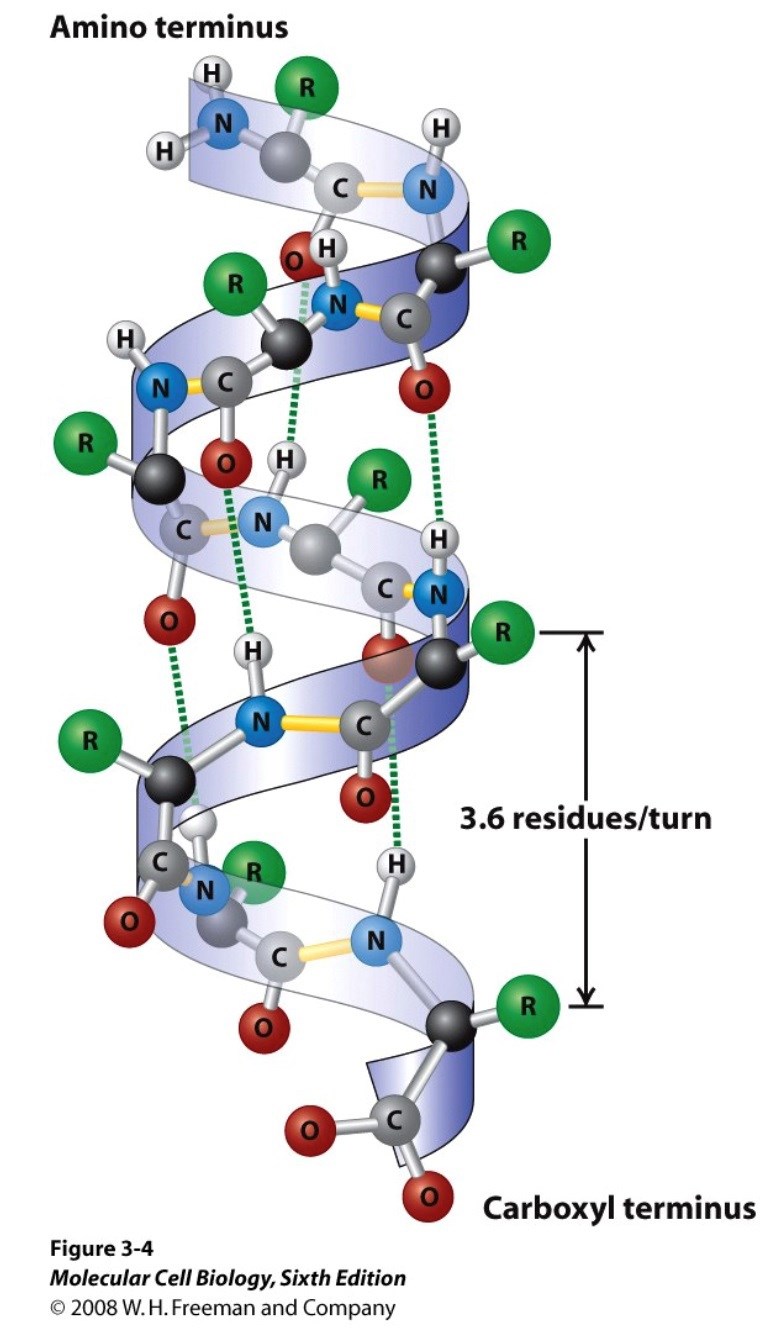
Icke-polära sidokedjor kan interagera med varandra, t.ex. från sidorna av två alfahelixar som möts(motsvarande att R-grupperna i bilden nedan interagerar med R-grupperna från en annan parallell helix), samtidigt som de polära peptidbindningarna vätebinder (gröna punktstrecken) skapar helixarna.