Jämvikt
I ett kärl med volymen 50,0 dm3 införs 0,600 mol kvävemonoxid, 0,200 mol klorgas och 0,500 mol nitrosylklorid, NOCl.
Jämvikten ställer in sig vid 1100 K (Kelvin).
2NO(g)+Cl2 (g) ⇄ 2NOCl (g)
a) Vid jämvikt finns i kärlet 0,600 mol nitrosylklorid. Hur stor mängd klorgas finns då i kärlet?
b) Beräkna jämviktskonstanten vid 1100 K.
Kan jag snälla få hjälp med denna uppgift. Jag har fastnat helt och hållet... Har gjort en tabell där jag skrivit nstart och njämvikt (där jag enbart kunnat fylla i n för nitrosylklorid...).
Det verkar som en bra start, men varför kan du bara skriva dit substansmängden för nitrosylklorid vid jämvikt? Om det har bildats 0,100 mol nitrosylklorid, så har det förbrukats... så då finns det ... mol NO och ... mol Cl2.
Lägg upp din tabell här när du har fått fram den!
Kan jag alltså tänka så enkelt som att när det har bildats 0,100 mol nitrosylklorid, har det förbrukats 0,120 mol kvävemonoxid och 0,040 mol klorgas. Och sedan multiplicera det med 6, för att få fram hur mycket klorgas som förbrukas när jag har 0,600 mol nitrosylklorid?
ezez skrev:Kan jag alltså tänka så enkelt som att när det har bildats 0,100 mol nitrosylklorid, har det förbrukats 0,120 mol kvävemonoxid och 0,040 mol klorgas. Och sedan multiplicera det med 6, för att få fram hur mycket klorgas som förbrukas när jag har 0,600 mol nitrosylklorid?
Nej, du måste titta på reaktionsformeln. Hur många mol NO behövs det för att bilda 1 mol nitrosylklorid? Hur många mol klorgas behövs det för att bilda 1 mol nitrosylklorid?
Om det stämmer att jag kan göra så, så ser min tabell ut såhär:
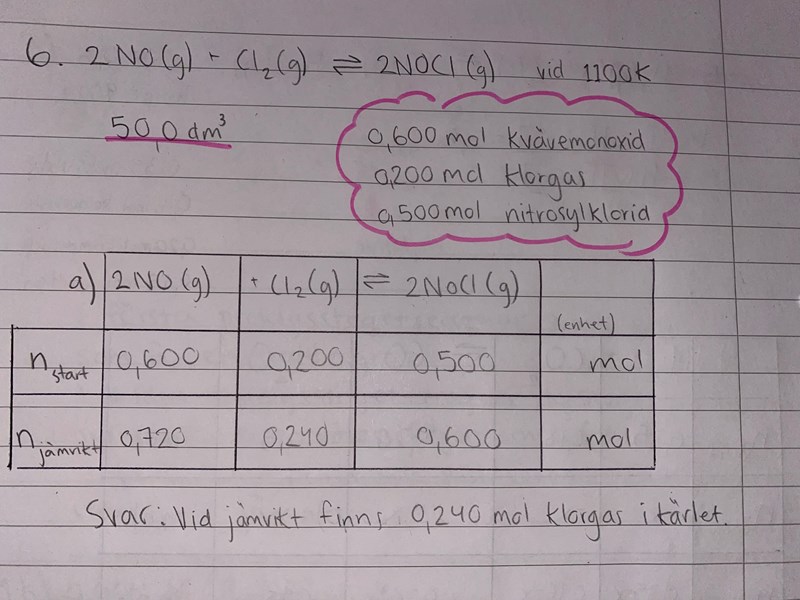
Nej, dina siffror stämmer inte. Gör en extra rad för "förändring" så blir det lättare att få rätt värden vid jämvikt. När det bildas mera nitrosylklorid förbrukas det NO och klorgas, d v s substansmängderna för dessa ämnen minskar, inte ökar som du har skrivit.
Hur många mol NO behövs det för att bilda 1 mol nitrosylklorid? Hur många mol klorgas behövs det för att bilda 1 mol nitrosylklorid?
Förhållandet är ju 2:1:2 mellan dessa.
Ja, men kan du vara snäll och svara på den frågan jag ställde och inte något annat?
Hur många mol NO behövs det för att bilda 1 mol nitrosylklorid? Hur många mol klorgas behövs det för att bilda 1 mol nitrosylklorid?
Det behövs 1 mol NO och 0,5 mol klorgas
Så om det har bildats 0,100 mol nitrosylklorid har det förbrukats ... mol NO (så det finns ... mol kvar) och ... mol klorgas (så´det finns ... mol kvar).
Räkna ut det som skall stå på de fyra prickade linjerna.
Om det har bildats 0,100 mol nitrosylklorid har det förbrukats 0,100 mol NO (så det finns 0,500 mol kvar) och 0,50 mol klorgas (så det finns 0,150 mol kvar)
Stämmer det?
Ja. Vilken är koncentrationen av de tre ämnena vid jämvikt?
Ska jag ta c = n/v och räkna med att volymen är 50,0 dm3 då?
[NO] = 0,500/50,0 = 0,01 M
[Cl] = 0,150/50,0 = 0,003 M
[NOCl] = 0,600/50,0 = 0,012 M
Har du lagt märke till att du har svarat på a-uppgiften?
Då är nästa steg att skriva uttrycket för jämviktskonstanten.
Uttrycket för jämviktskonstanten blir:
K = [NOCl]2/( [NO]2 • [Cl2] )
Och jag ska räkna med koncentrationerna från uppgift a, antar jag?
Tusen tack för hjälpen verkligen!!! Tack tack tack!


