Jämviktskoncentrationer av gaser från känd jämviktskonstant
0,020 mol NO2 fördes in i en behållare med volymen 1,00 l och reaktionen 2 NO2 (g) ⇌ N2O4 (g) läts komma i jämvikt vid 298 K. Beräkna jämviktskoncentrationerna av de två gaserna med hjälp av följande jämviktskonstanter:
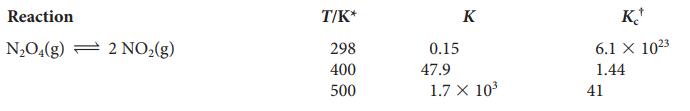
Eftersom jag har fått substansmängden och volymen och dessutom vill ha ut jämviktskoncentrationer känns det rimligt att räkna med jämviktskonstanten KC. Denna är ju dock för reaktionen N2O4 (g) ⇌ 2 NO2 så jag tänker att jag måste ta den omvända jämviktskonstanten, dvs . Eftersom jämviktkonstanten är så väldigt liten antar jag att skillnaden i koncentration < 5% och att den därför kan bortses från i addition/subtraktion i jämviktsuttrycket jag ställer upp.

Facit säger dock att och . Detta är ju inte i närheten av mina svar, så jag undrar var det kan ha gått snett i min beräkning.
Hur definieras K respektive Kc? Vad betyder symbolen uppe till höger om Kc?
K är jämviktskonstanten då ämnenas komposition uttrycks i partialtryck, KC är jämviktskonstanten då ämnenas komposition uttrycks i molär koncentration. Symbolen över KC förtydligar bara att det är just koncentrationsberoende (som en * där de förklarar detta under figuren).
Eftersom din metod gav fel svar, vore det kanske vettigt att försöka räkna med K istället. Vad får du för resultat om du gör det?
Betydligt bättre storleksordning. Nu har jag och , men det är ju fortfarande inte exakt samma svar som de fick.
Dessutom undrar jag fortfarande varför det kunde bli så fel i den förra beräkningen, se #1. Jag har använt den metoden många gånger på liknande problem utan att det har varit krångel.



