Jämviktskonstant
Hej!
 Kan någon hjälpa mig förstå i vilket steg jag räknar fel? När man tillför 4 mol kvävgas, samt 1 mol syrgas, i syfte att bilda kväveoxid, NO, så måste svaret (enligt facit) bli att man får 0.17 mol NO i systemet! Hur får jag fram en sådan substansmängd för kväveoxiden?
Kan någon hjälpa mig förstå i vilket steg jag räknar fel? När man tillför 4 mol kvävgas, samt 1 mol syrgas, i syfte att bilda kväveoxid, NO, så måste svaret (enligt facit) bli att man får 0.17 mol NO i systemet! Hur får jag fram en sådan substansmängd för kväveoxiden?
Tack på förhand!
Om det förbrukas 1 mol N2 och 1 mol O2 så bildas det 2 mol NO, inte 1 mol. Om det förbrukas x mol N2 och x mol O2 så bildas det x2 2x mol NO, inte x mol.
EDIT: Rättade till ett löjligt fel jag hade gjort.
Ha ha, Jag är så ny på det här kapitlet, tusen Tack!
Hej igen,
Jag har inte min ordinarie lärare att be om hjälp nu under julen så jag får fråga här igen. Har jag börjat rätt nu då?
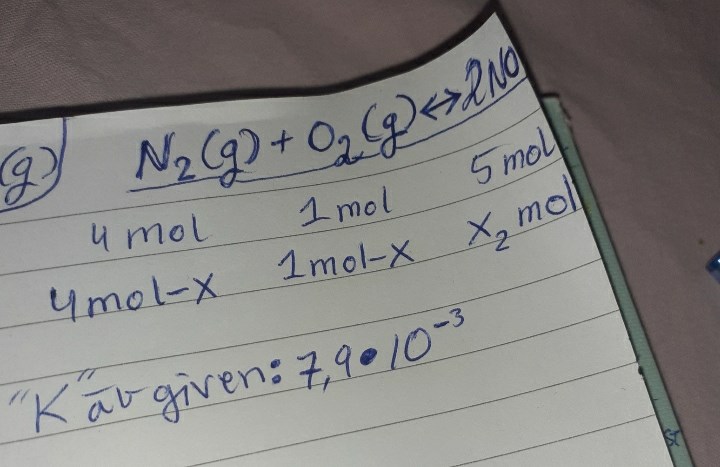
Nej. Från början har du 4 mol N2, 1 mol O2 och 0 mol NO.
Om x mol kvävgas reagerar med x mol syrgas så bildas det 2x mol NO.
Vid jämvikt finns det alltså 4-x mol N2, 1-x mol O2 och 2x mol NO.
Jag ser att jag lurade dig med att skriva konstigt i mitt förra inlägg - det bildas alltså 2x mol NO. Jag rättar till det felaktiga som jag skrev (att kunna ändra sina inlägg även senare än efter 2 timmar är en bonus med att vara moderator).
Ha ha, ja, så bra det är att vara moderator!
Toppen, tack igen!
Fast om du behöver ändra något efter mer än 2 timmar kan du skicka ett PM till någon av oss moddar.



