Jämviktskonstant och kopplade reaktioner
Ur Biokemiboken:
"Suppose that the standard free energy change of the conversion of compound A into compound B is +16.7 kJ/mol
A <=> B
delta(G)O' = +16.7 kJ/mol
K'eq for this reaction at 25oC is related to delta(G)O' through
K'eq = [B]eq / [A]eq = e-delta(G)o'/2.47 = 1.15 * 10-3
Thus net conversion of A into B cannot take place when molar ratio of B to A is equal to or greater than 1.15*10-3. However A can be converted into B under these conditions if the reaction is coupled to the hydrolysis of ATP. Under standard conditions the delta(G)o' of hydrolysis of ATP is approximately -30.5 kJ/mol. The new overall reaction is
A + ATP + H2O <=> B + ADP + Pi
delta(G)o' = 13.8 kJ/mol
At pH7 the equilibrium constant of this coupled reaction is
K'eq = [B]eq / [A]eq * = e13.8/2.47 = 2.67*102
At equilibrium the ratio of [B] to [A] is given by
[B]eq/[A]eq =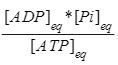 *K'eq
*K'eq
This means that the hydrolysis of ATP enables A to be converted into B until [B]/[A] ratio reaches a value of 2.67*102.
If we were to use delta(G) of hydrolysis of ATP under cellular conditions [-50.2 kJ/mol] in our calculations instead of delta(G)o' , the change in equilibrium ratio would be even more dramatic, on the order of 108."
Jag hänger inte med i detta. Och jag hoppas att det är okej att skriva olika frågor i en tråd för alla hör till texten ovan - hur man ska förstå den.
3 första frågor:
1) Varför använder man här i beräkningarna standard delta(G) vid 25C och pH7 istället för att bara räkna med delta(G) vid cellulära förhållanden 37C och pH7 från start?
2) K högt upp i utdraget från boken är 1.15*10-3 . Varför skulle detta betyda att molar ratio inte får vara lika med eller större än detta talet?
3) Varför ser den nya jämviktskonstanten ut så för de kopplade reaktionerna?
(något att söka på så jag kan lära mig detta?)
4) Den sista ekvationen, där man säger att vid den kopplade reaktionen så kan hydrolys av ATP ge att A kan omvandlas till B tills ration når 2.67*102 :
Igen då - som andra frågan - hur ska jag se detta?
1) För att det är som finns i alla tabeller, och det är enklare att räkna o än att göra nya tabeller
2) Det betyder att jämvikten "går baklänges" om det finns för mycket A
3) Det är en annan reaktion, så den har en annan jämviktskonstant
4) Det kan finnas mycket mera A innan reaktionen "går baklänges"
Är detta svar på dina frågor? Om inte, fråga mer!
Hm...
1) men längre ner i texten skriver man ju om delta(G), Mao verkar det ju som man har siffrorna så förstår inte varför man inte bara använder de verkligen talen för vad aom faktiskt finns i cellen.
3) jag tänkte mer på uppställningen - varför man gångrar de två reaktionernas K man adderar ihop. Hur man kan få göra så.
nej men vänta :) såg nu varför! Blir ju helt enkelt samma som alltid med reaktanterna och produkterna, att man gångrar ihop dem. Var uppställningen som gjorde jag inte såg det först.
2) och 4)
menar du verkligen att det kan finnas mkt mer reaktanter (A) innan reaktionen går baklänges? Inte produkter?
Nej, det var B jag menade.


