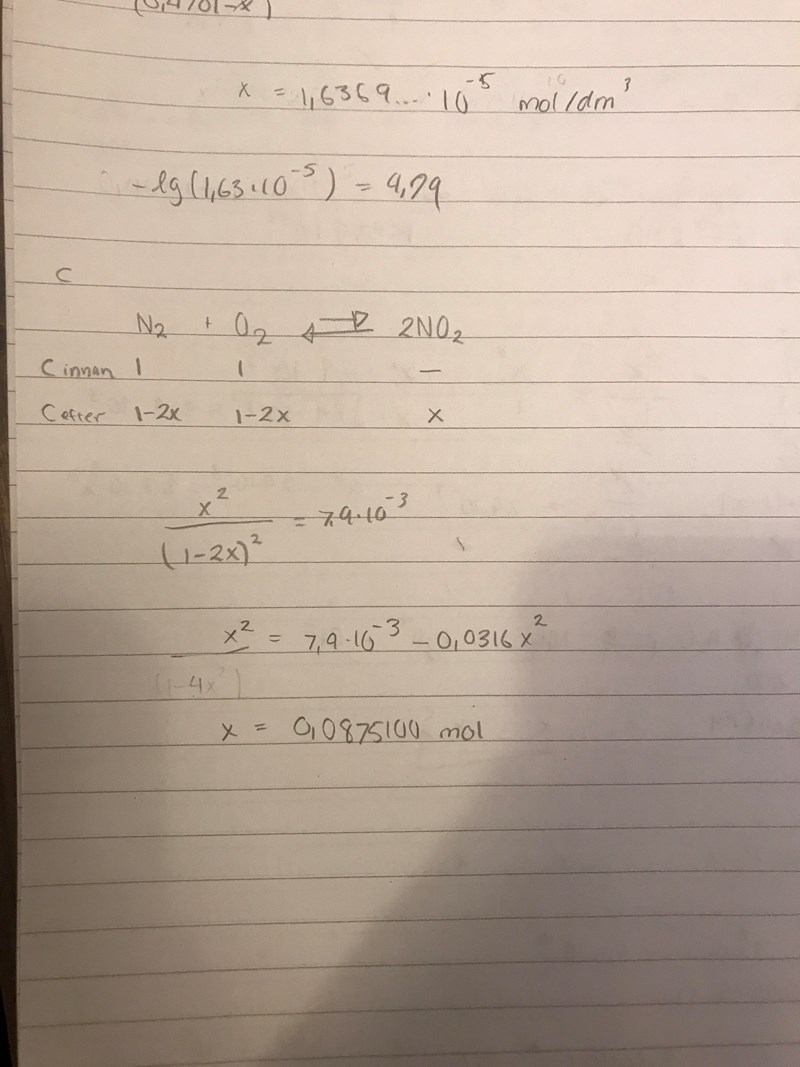Jämviktskonstanten
Kväve och syre kan reagera och bilda kväveoxid enligt n2 + o2 <——> 2NO
vid 2500 grader är jämviktskonstanten 7,9*10^-3
Hur stor substansmängd NO innehåller systemet vid jämvikt om man utgår från 1,0 mol n2 och 1,0 mol o2.
Tänker såhär men får fel:

Vad står det i facit?
8,5x10^-2
Du har räknat med att det finns 1 mol av vardera reaktant vid jämvikt, men man menar att det fanns 1 mol innan jämvikt. Nu är jämviktskonstanten ganska liten, så du kommer ha kvar nästan 1 mol vid jämvikt. Men du måste motivera varför det går att sätta in 1 mol direkt.
Det ser ut som att du har gjort något konstigt på slutet när du beräknar kvadratroten.
Du har inte tagit hänsyn till att det har förbrukats kvävgas och syrgas vid reaktonen. Hur mycket kvävgas har det förbrukats, om det har bildats x mol NO?
Det blir ju fortfarande fel?
Det går inte åt 2 mol kvävgas för att bilda 1 mol NO, det går åt ½ mol.
Okej nu blev det rätt. Men måste det vara såhär komplicerat? Det är ju inte ens rimligt
Vad är det du tycker är komplicerat? Vad är det du tycker är orimligt?
Hej!
Ser detta rätt ut? Tacksam för svar!! Sorry dålig handstil

Det här ser ut att vara en helt annan fråga (visserligen om samma jämvikt). Starta en ny tråd om din fråga! /moderator