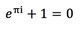Jämviktsreaktion
Hej!
Jag skulle behöva lite hjälp med att ge mig på denna uppgift. Vad ska jag börja med att göra?

Skriv en reaktionsformel för den kvantitativa reaktion som sker innan jämvikten börjar ställa ain sig. Beräkna hur många mol kvävedioxid som har bildats.
Skriv upp uttrycket för jämviktskonstanten för reaktionen mellan kvävedioxid och dikväveoxid.
Beräkna antalet mol gas totalt med hjälp av idealgaslagen.
Dessa steg kan du göra i vilken ordning du vill, men du kommer att behöva dem alla. Här kommer några följande steg:
Skriv ett uttryck för hur många mol kvävedioxid repektive dikvävetetroxid det finns om x mol NO2 har reagerat. Eftersom du har räknat ut hur många mol gas det är totalt, kan du beräkna värdet på x.
Beräkna koncentrationen av de båda gaserna. Sätt in koncentrationerna i uttryckt för jämviktskonstanten. Beräkna jämviktskonstanten.
Behöver du mer hjälp, så visa hur långt du har kommit och fråga igen.
Tack för snabbt och utförligt svar :)
Blir den kvantitativa reaktionen då: NO + O --> NO2 + N204 (obalanserad) ?
Nej, det bildas bara NO2. Sedan reagerar 2 molekyler NO2 med varandra, men det är nästa steg. Du behöver räkna ut hur många mol NO2 du har innan jämvikten "börjar gå igång". I verkligheten sker säkert den reaktionen redan innan allt syre har hunnit reagera med NO:n, men som tur är behöver man inte räkna på det sättet.