Kaliumnitrit (Följdfråga till löst uppgift: Varför blir syret med enkelbindning den negativa delen?)
Hej.
Uppgift 4:15 g) Vilken formel har jonföreningen "Kaliumnitrit"?
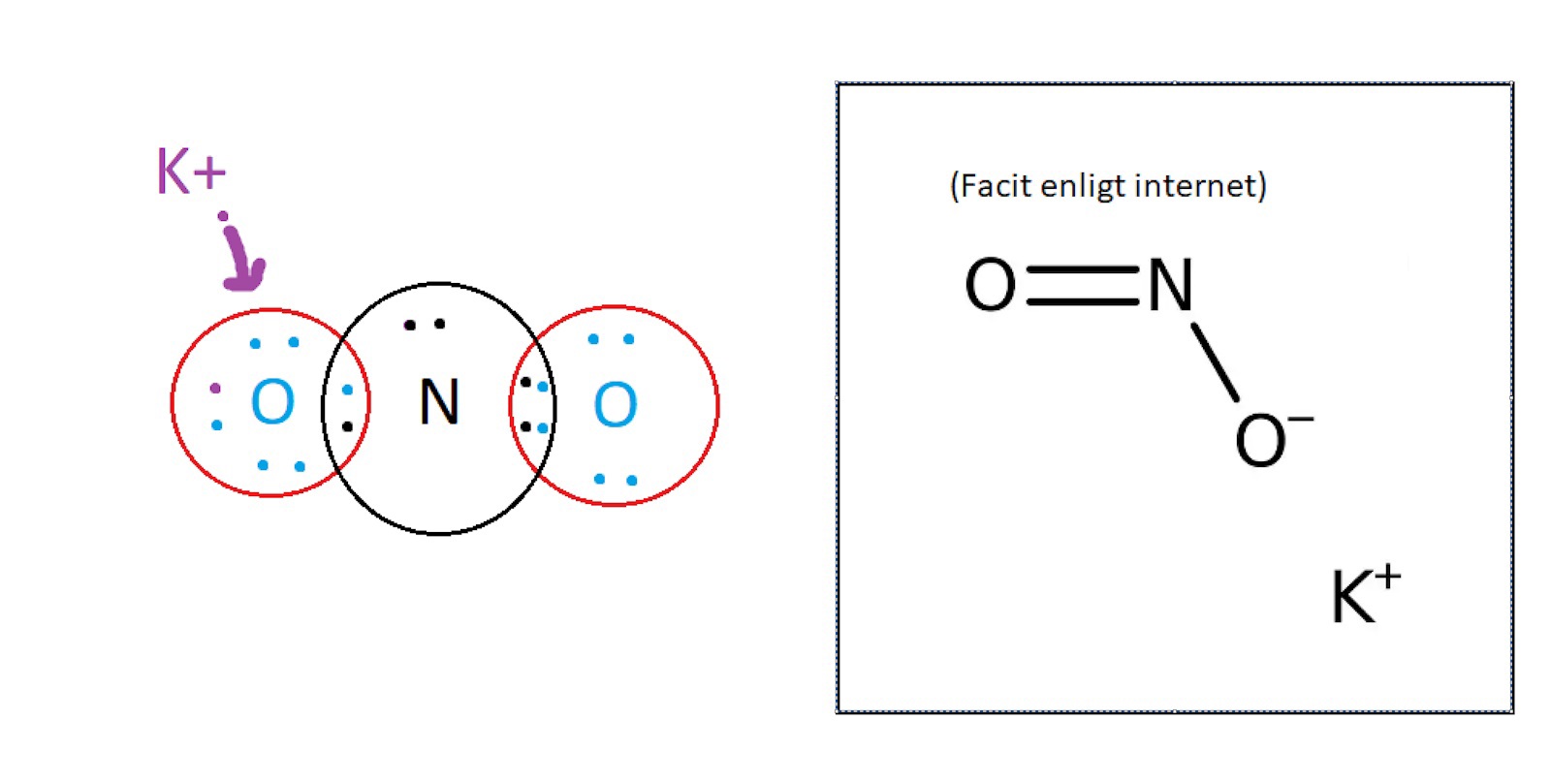
Efter att jag tog reda på att det är en dubbelbindning mellan en av syreatomerna och kvävet så gick det tillslut ihop, och att slutgiltiga formeln blir KNO2 där laddningarna är [K]+ [NO2]- däremot visar internet att den delen med enkelbindningen är den som blir negativ. Borde det inte bli tvärt om?
Min tankegång är:
Enkelbindningen runt det ena syret låser enbart 1 av kvävets elektroner "runt sig", medans den med dubbelbindning låser upp 2st elektroner runt sig. Borde det inte rimligtvis bli ett överskott av negativa laddningar runt dubbelbindningen då?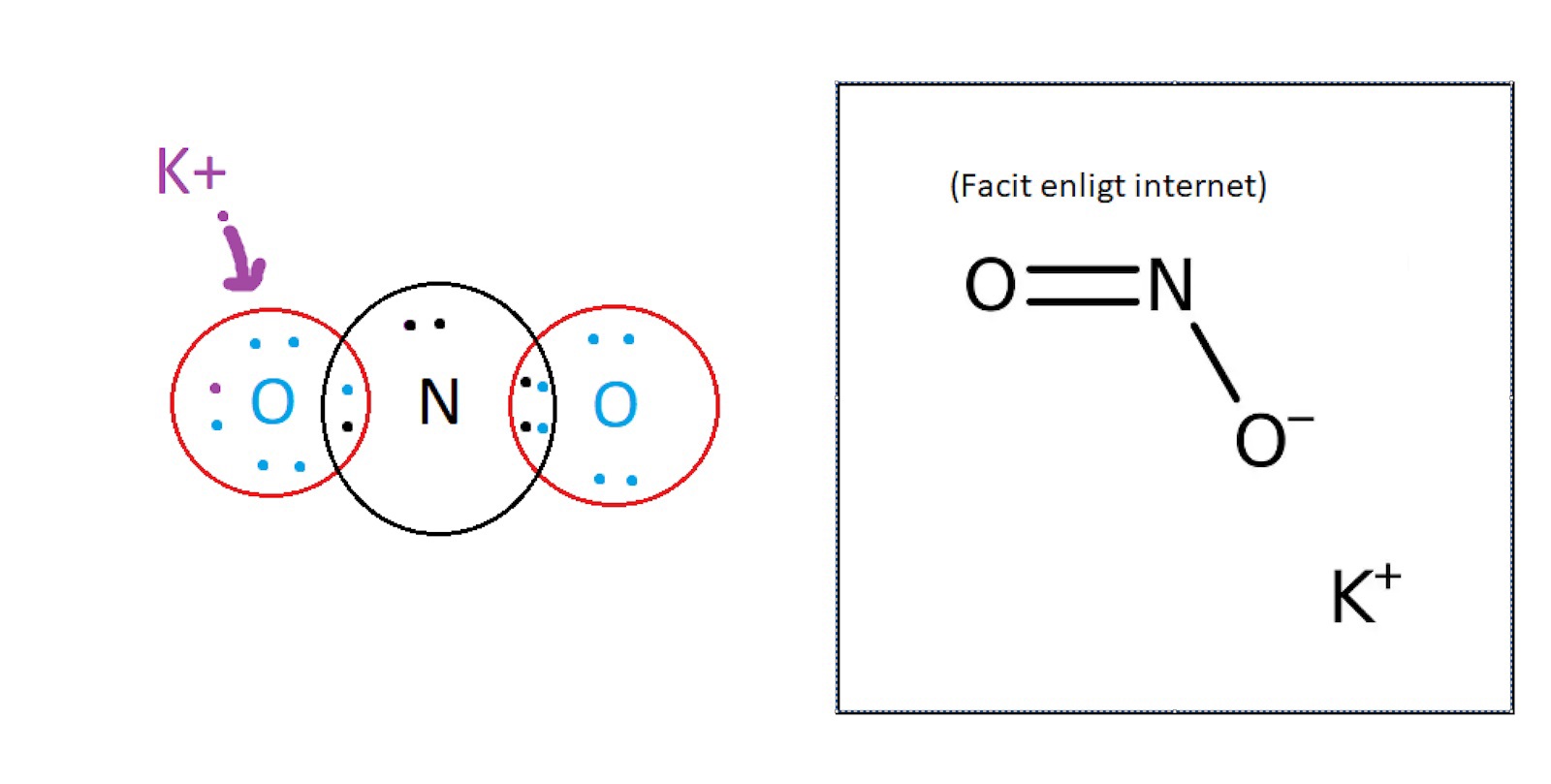
Tacksam för svar!
Skepnad skrev:Hej.
Uppgift 4:15 g) Vilken formel har jonföreningen "Kaliumnitrit"?
Efter att jag tog reda på att det är en dubbelbindning mellan en av syreatomerna och kvävet så gick det tillslut ihop, och att slutgiltiga formeln blir KNO2 där laddningarna är [K]+ [NO2]- däremot visar internet att den delen med enkelbindningen är den som blir negativ. Borde det inte bli tvärt om?
Min tankegång är:
Enkelbindningen runt det ena syret låser enbart 1 av kvävets elektroner "runt sig", medans den med dubbelbindning låser upp 2st elektroner runt sig. Borde det inte rimligtvis bli ett överskott av negativa laddningar runt dubbelbindningen då?
Tacksam för svar!
Syreatomen med dubbelbindningen har 8 elektroner i sitt yttersta elektronskal: Två fria elektronpar och två bindande elektronpar. Elektronerna i det bindande elektronparet räknas lika mycket till syreatomen som till kväveatomen, så det blir en elekton från vardera bindningen och två från varje fritt elektronpar, 6 totalt. Tillsammans med de båda elektronerna i det inre elektronskalet blir det 8 elektroner totalt, lika många som antalet protoner i kärnan. Denna syreatom är alltså oladdad.
Syreatomen med enkelbindningen har 8 elektroner i sitt yttersta elektronskal: Tre fria elektronpar och ett bindande elektronpar. Elektronerna i det bindande elektronparet räknas lika mycket till syreatomen som till kväveatomen, så det blir en elekton från vardera bindningen och två från varje fritt elektronpar, 7 totalt. Tillsammans med de båda elektronerna i det inre elektronskalet blir det 9 elektroner totalt, en mer än antalet protoner i kärnan. Alltså är den syreatomen negativt laddad.