Kemi - Titrering - Buffert
Bakgrund:
Bestäm koncentrationen för en ammoniaklösning
När man titrerar tillsätter man ett ämne till ett annat med hjälp av en byrett. I den här titreringen ska du bestämma koncentrationen av en vattenlösning av en svag bas (NH3) genom att tillsätta saltsyralösning (HCI) droppvis till ammoniaklösningen. Med hjälp av en pH-meter bestäms pH. Sedan avsätts pH-värdet mot tillsatt mängd saltsyra i ett diagram - man får då en så kallad titrerkurva. Med hjälp av denna kurva lokaliseras ekvivalenspunkten, d v s den punkt då man tillsatt lika stor substansmängd syra som substansmängden bas i den ursprungliga lösningen. Sedan kan koncentrationen av ammoniak bestämmas.
Kemikalier och materiel: NH3(aq) okänd konc., HCI(aq) 0,10 mol/dm', vollpipett 10 cm', byrett 25 cm', tratt, bägare 200 cm', magnetomrörare och magnet, pH-meter (kalibrera), slaskbägare, stativ.
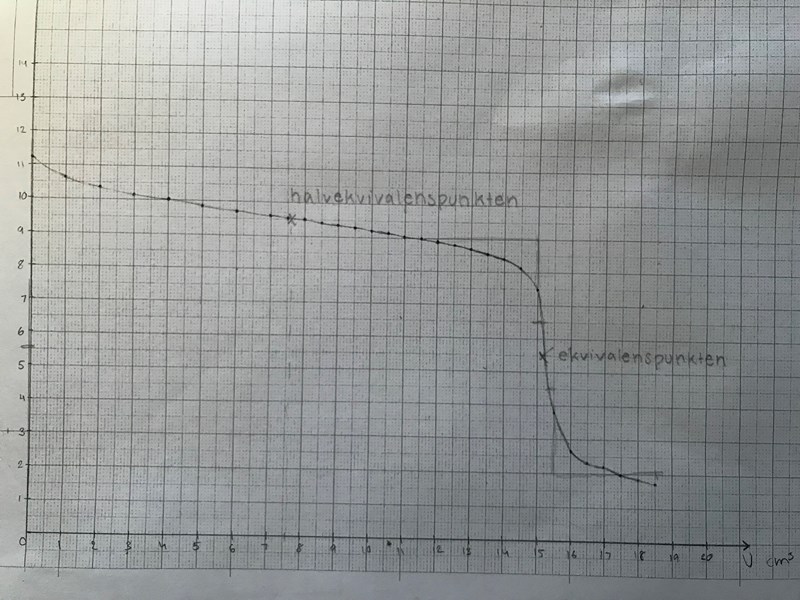
6. När fungerar lösningen bäst som buffertlösning? Motivera noggrant. 1/1/0
Skrev så här:
I halvtitreringspunkten funkar lösningen bäst som buffert eftersom där är [NH4+]=[NH3]
En bra buffert består av ett syra-bas-par, som NH4+ (svag syra) och NH3 (svag bas)
Hur kan jag motivera noggrannare och stämmer det jag skrivit?
Det du har skrivit stämmer. Du skulle kunna lägga till lite om hur långt från pKa bufferten fungerar hyfsat.


