Kemisk jämvikt
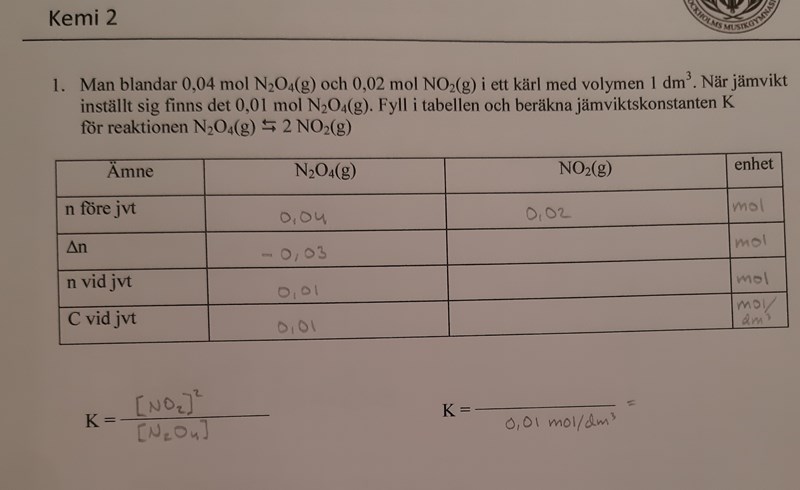
Visst behöver man redan känna till jämviktskonstanten för att kunna fylla i resten av den här tabellen? Jag har räknat ut koncentrationskvoten Q för värdena innan jämvikt (0,02 mol NO2 och 0,04 mol N2O4), men eftersom jag inte redan känner till jämviktskonstanten kan jag inte jämföra Q-värdet med K... jag är lite förvirrad över hur jag kommer vidare.
Skulle någon vilja hjälpa?
Du behöver inte känna till jämviktskonstanten för att kunna fylla i resten av tabellen. Du behöver titta på reaktionsformeln och konstatera att om det förbrukas 0,03 mol N2O4 så bildas det ... mol NO2. Alltså finns det... mol NO2 vid jämvikt.
Tack!
Så om jag har förstått det rätt ska det bildas 0,06 mol NO2 eftersom det finns dubbelt så mycket NO2 som N2O4? Och då blir det 0,08 mol NO2 vid jämvikt (vilket blir rätt svar).
Det här kanske är en dum fråga, men hur kan jag veta att det bildas mer NO2 när det blir mindre N2O4? Finns det med andra ord någon regel för om det är produkten eller reaktanten som minskar eller ökar?
Om du vet jämviktskonstanten kan du beräkna Q-värdet och jämföra det med k-värdet, precis som du var inne på i ditt förstainlägg.


