Kemiskt utbyte

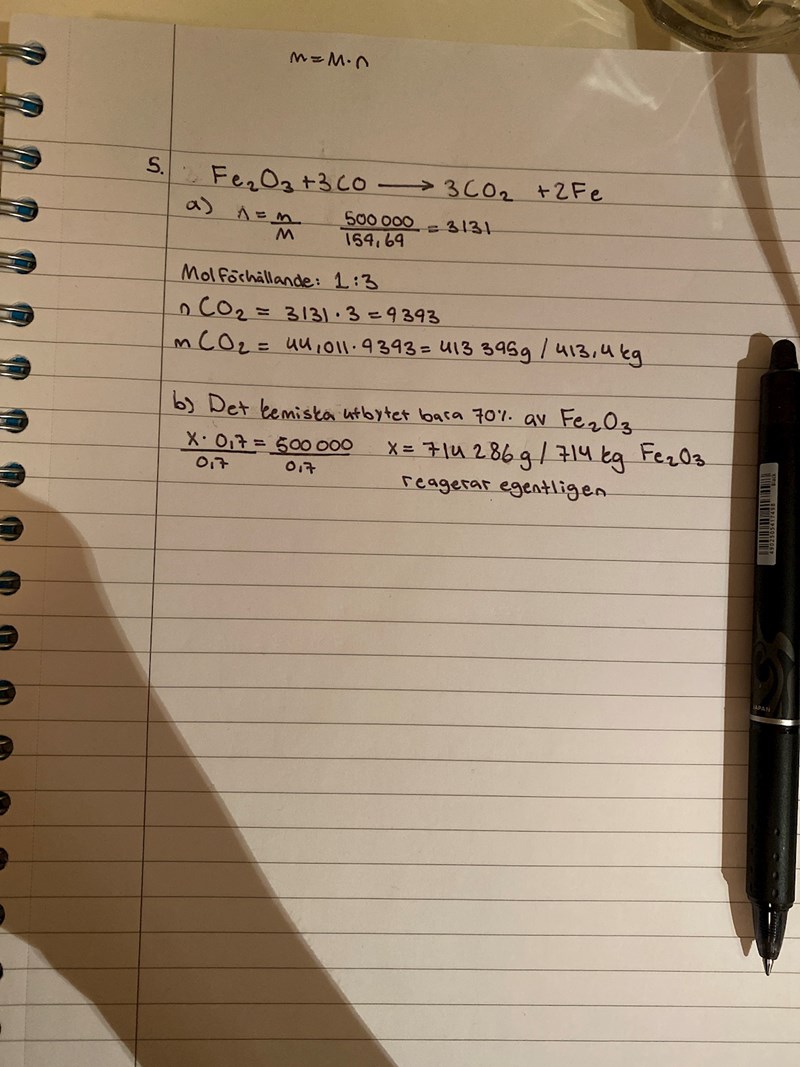 Hej!
Hej!
Jag har lite problem med en fråga angående kemiskt utbyte. Jag har räknat ut a) men har fastnat lite på b) för förstår inte riktigt hur man ska tänka. Det jag har gjort än så länge är att räkna ut hur mycket Fe2O3 som faktiskt reagerade för att utbytet ska vara 70% men förstår inte riktigt hur jag ska komma vidare på b)? Ska man bara fortsätta att räkna fast utgå från att massan Fe2O3 är 714 kg från början och inte 500 som jag skrivit på pappret?
Tacksam för hjälp!
Nej, du har fortfarande 500 kg hematit som reagerar. (Du tänker nog på uppgifter av typen "Hur många mol hematit behövs det för att bilda 200 kg järn, om utbytet är 70 %?". Då behöver man ha extra mycket av utgångsämnet.)
Om utbytet hade varit 100 % skulle det ha bildats 2 mol järn för varje mol hematit, d v s 6 262 mol. Vilken massa skulle så mycket järn ha? (Detta är det teoretiska utbytet.)
Nu är utbytet bara 70 %, så det bildas 70 % av det teoretiska utbytet. Vilken massa är detta?
Smaragdalena skrev:Nej, du har fortfarande 500 kg hematit som reagerar. (Du tänker nog på uppgifter av typen "Hur många mol hematit behövs det för att bilda 200 kg järn, om utbytet är 70 %?". Då behöver man ha extra mycket av utgångsämnet.)
Om utbytet hade varit 100 % skulle det ha bildats 2 mol järn för varje mol hematit, d v s 6 262 mol. Vilken massa skulle så mycket järn ha? (Detta är det teoretiska utbytet.)
Nu är utbytet bara 70 %, så det bildas 70 % av det teoretiska utbytet. Vilken massa är detta?
Blir det såhär då??

Ja, det ser bra ut.


