Kemiteknik: energibalans konceptuell förståelse
Frågan lyder:
 -----------------
-----------------
I facit tänker man alltså att rumstempererade produkter går in, och reaktionen producerar värme (-92310kJ/mol) varav en del går till att värma produkten till 800. Uppgiften går alltså ut på att räkna hur mycket värme som avges (tex från reaktionskärlens väggar), EXKLUSIVE den som kommer av att produkten är varmare än reaktanterna.
Ur ett praktiskt perspektiv, varför vill man veta detta? För att bygga ett kylsystem?
Ifall man bygger ett kylsystem kommer man ändå vilja kyla produkten, så varför inte på denna fråga bara svara 92310kJ/mol eftersom det är den värmen man kommer behöva föras bort för att få rumstempererade produkter?
Ur ett praktiskt perspektiv, varför vill man veta detta? För att bygga ett kylsystem?
Det skulle definitivt kunna vara användbar info om man ska konstruera ett kylsystem. Det kan också vara bra att veta om man t.ex. vill producera värme som en biprodukt, kanske till fjärrvärmenätet.
Ifall man bygger ett kylsystem kommer man ändå vilja kyla produkten, så varför inte på denna fråga bara svara 92310kJ/mol eftersom det är den värmen man kommer behöva föras bort för att få rumstempererade produkter?
Man kanske inte vill ha rumstempererade produkter. Låt säga att vätekloriden går in i en ny reaktor eller separator där man vill ha en hög temperatur, varför skulle då produkterna kylas ner? Det vore slöseri av energi.
Teraeagle skrev:
Det skulle definitivt kunna vara användbar info om man ska konstruera ett kylsystem. Det kan också vara bra att veta om man t.ex. vill producera värme som en biprodukt, kanske till fjärrvärmenätet.
Åh... smart
Man kanske inte vill ha rumstempererade produkter. Låt säga att vätekloriden går in i en ny reaktor eller separator där man vill ha en hög temperatur, varför skulle då produkterna kylas ner? Det vore slöseri av energi.
Ja...
Men min tolkning av vad uppgiften går ut på, rätt?
Ja det du skrev i ditt inlägg är korrekt, ifall det är vad du menar?
Pappersbruk är ofta väldigt bra på att ta reda på spillvärme och använda den för att producera el och värme till sina egna produktionsprocesser. Man bränner biprodukterna från massakokning, en svart trögflytande vätska som kallas för svartlut och som främst innehåller lignin. Detta görs i sodapannor som är kopplade till värmeväxlare och elgeneratorer:
https://sv.wikipedia.org/wiki/Sodapanna
Ett pappersbruk skulle inte gå att driva med samma lönsamhet om man inte tog reda på energin på detta sätt.
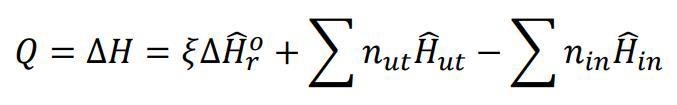
Uttryckt med matte så är det detta uttryck som beskriver värmen som avges. Den första termen brukar inte ges i frågan. Vi räknar "heat of formation" som det finns tabellvärden för vid 25 grader. I denna fråga låtsas vi som att reaktionen sker vid 25 (det är verkligen inte 25 grader i en sån reaktor) och sen värmer vi produkten till 800. Energin som går till att värma produkten är inbakad i den andra termen.
Jag sitter nu med en annan fråga där två reaktanter förs in vid 200 respektive 500 grader och produkten kommer ut med 1000 grader. Ska jag då låtas som att jag kyler reaktanterna till 25, reagerar de, och värmer produkten till 1000 grader?
Det spelar ingen roll vid vilken temperatur som reaktionen äger rum när man gör en energibalans. Entalpi är en tillståndsfunktion, vilket innebär att ”vägen” inte har någon betydelse för slutvärdet. Det som påverkar värdet på reaktionsentalpin är vad du kör in för reaktanter och deras temperatur, samt vilka produkter som kommer ut och deras temperatur.
Du kan alltså ta skillnaden i entalpi mellan produkterna och reaktanterna, alternativt kyla reaktanterna till 25 grader och sedan värma produkterna till 1000 grader. Du kommer få samma svar, men den första metoden är mycket enklare.
Nu blir det offtopic, men kan en anläggning även "sälja" sin överblivna energi? Hur "populärt" är det att göra det? Är det främst storskaliga fabriker som gör det/kan göra det? Jag kan tänka mig att de flesta anläggningar har någon form av spillvärme de kan utnyttja
Qetsiyah skrev:Nu blir det offtopic, men kan en anläggning även "sälja" sin överblivna energi? Hur "populärt" är det att göra det? Är det främst storskaliga fabriker som gör det/kan göra det? Jag kan tänka mig att de flesta anläggningar har någon form av spillvärme de kan utnyttja
Det är vanligt att sälja värme om man producerar ett överskott. Det finns ju små jordbruk som producerar egen biogas på gården från gödsel och liknande. Då kan de bränna gasen för att t ex värma ett växthus. När det är så pass småskaligt använder man energin själv. Stora fabriker som stålverk och oljeraffinaderier exporterar däremot värme.
"skillnaden i entalpi mellan produkterna och reaktanterna" är väl andra och tredje termen i den där formeln?
Känns lite pinsamt för jag ska ju veta det här, men vadå skillnad i entalpi mellan två ämnen? Entalpiskillnad i en reaktion vet jag vad det är
Ekvationen du skrev innehåller reaktionsentalpin vid SATP-villkor, vilket är det tillstånd som avses med den där lilla ringen uppe till höger om H:et. Då är temperaturen 25 grader.
Om vi rent hypotetiskt antar att reaktionen skulle ske vid 25 grader:
Alt 1: Kyl reaktanterna till 25 grader. Genomför reaktionen. Värm produkterna till 1000 grader. Summera alla energier för att ta reda på den totala entalpiändringen.
Alt 2: Reagera de två reaktanterna direkt vid deras ursprungliga temperaturer och bilda produkterna vid 1000 grader.
Om du utför dessa två beräkningar kommer du se att det frigörs lika mycket energi i båda fallen. Man behöver alltså inte veta vid vilken temperatur reaktionen sker, utan man kan direkt reagera något som håller 200 respektive 500 grader med varandra och direkt bilda något vid 1000 grader. Det är såklart inte så det går till i verkligheten, men man får fram rätt värde i alla fall. Det beror på att entalpin är en tillståndsfunktion.
Temperatur är ett annat exempel på en tillståndsfunktion. Du vet att något håller 10 grader från början och 100 grader vid slutet. Hur stor är temperaturändringen? Det spelar ingen roll om du har höjt temperaturen till 200 grader, sänkt den till absoluta nollpunkten och sedan höjt den till slutliga 100 grader. Temperaturändringen är ändå 90 grader. Med andra ord är det bara startvärde och slutvärde som har betydelse för temperaturändringen.
Arbete är inte en tillståndsfunktion. Om du ska beräkna hur mycket arbete som går åt för att lyfta något från 0 till 10 meter så har vägen betydelse. Om du först höjer föremålet till 20 meter och sedan sänker det till 10 meter så krävs dubbelt så stort arbete jämfört med om du hade höjt det 10 meter direkt.
Okej... Jag läste det du skrev igen. För det första ska jag inte råka glömma den där lilla ringen! De två sista termerna tar hänsyn till skillnad i energi pga värmekapacitetskillnad och temp-skillnad mellan in och ut material, skillnaden pga skapande och brytande av kemiska bindningar finns i första termen. Pga ringen (som säger att värdet är för 25C) måste därför är integralerna som gömmer sig bakom andra och tredje termen börja från 25.



