Koncentration
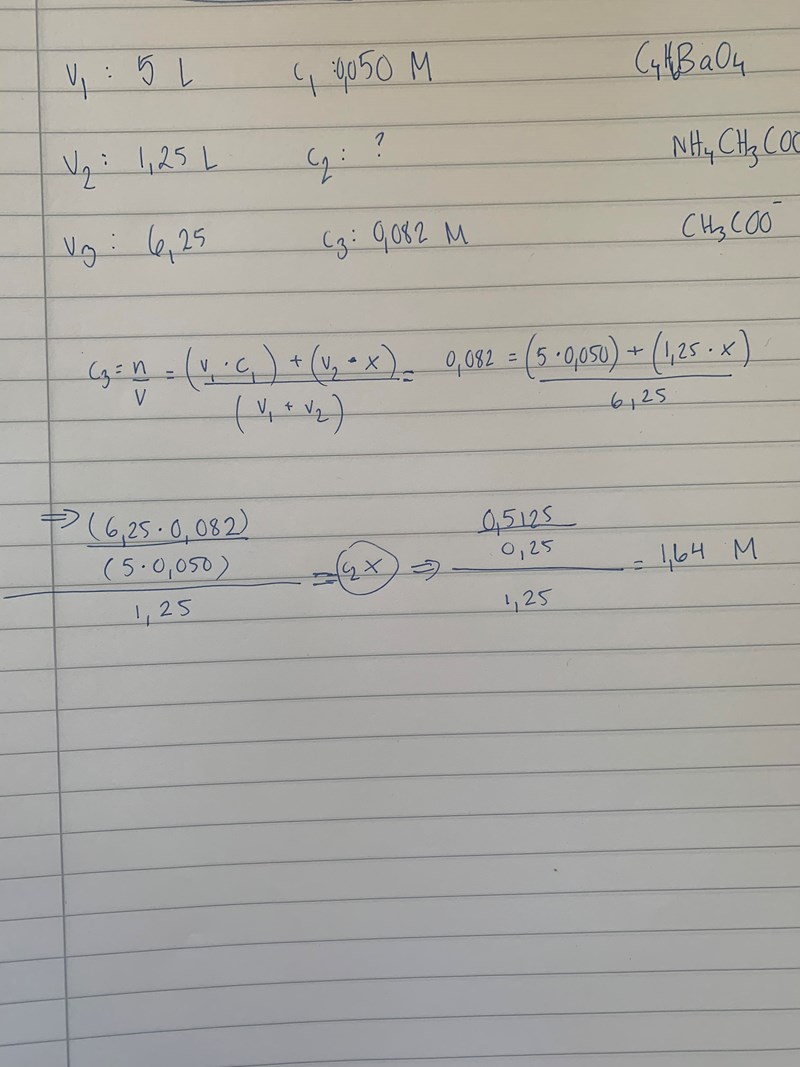 hej, har problem med dessa uträkningar där jag har två blandningar som blir en.
hej, har problem med dessa uträkningar där jag har två blandningar som blir en.
nu är det c2 som efterfrågas och jag får inte rätt svar. Vad är det jag missar att tänka på?
behöver jag balansera upp en formel? Hur vet jag vad hela produkten blir utav reaktanter?
Kan du lägga in en bild av uppgiften? Det är svårt att veta vad man skall räkna fram när man inte har själva frågan.
Ja, såklart, ursäkta. Här är frågan:
5 L volym av en 50 mM koncentration bariumacetat-lösning blandas med 1,25×10⁶ μL volym av en ______ koncentration lösning av NH₄CH₃COO. Koncentrationen av CH₃COO⁻ jonen i den resulterande lösningen blir 0,082 M
Vilken formel har bariumacetat?
C4H6BaO4 (Bariumacetat) tänk nedsänkta siffror
Nej. Formeln för ett salt skrivs alltid med först den positiva jonen, sedan den nefgativa jonen, som NaCl exempelvis, eller Al2(SO4)2. Då ser man att 1 mol natriumklorid består av 1 mol natriumjoner och 1 mol kloridjoner, och att 1 mol aluminiumsulfat består av 2 mol aluminiumjoner och 3 mol sulfatjoner. Som du ser bryr man sig inte om att skriva ut jonladdingarna när man skriver formeln för saltet. Du kan kalla acetatjonen CH3COO- för Ac-. Hur ser formeln för bariumacetat ut? Hur många mol bariumjoner finns det i 1 mol bariumacetat? Hur många mol acetatjoner finns det i 1 mol bariumacetat?
Ba(CH3COO)2 ?
1 mol barium och 2 mol acetat i 1 mol bariumacetet.
Vilken är koncentrationen av acetatjoner i lösningen som har koncentrationen 50 mM m a p bariumacetat?
n Ba(C2H3CO2)2=5*0,005= 0,025 mol/dm-3
Mol förhållande mellan Ba och Ac- 1:2
c(Ac-) = 2*0,025 = 0,05
?
Matte 4 skrev:n Ba(C2H3CO2)2=5*0,005= 0,025 mol/dm-3
Mol förhållande mellan Ba och Ac- 1:2
c(Ac-) = 2*0,025 = 0,05
?
Du har skrivit av uppgiften fel. Koncentrationen av bariumacetat är 0,050 mol/dm3 (inte 0,0050) så koncentrationen av acetatjoner är 2.0,050 mol/dm3 = 0,010 mol/dm3 och då innehåller innehåller 5 liter av lösningen 0,50 mol acetatjoner.
Du blandar denna lösning med 1,25 dm3 av en lösning med okänd acetatkoncentration. Blandningen har acetatjonkoncentrationen 0,0820 mol/dm3.
Hur många mol acetatjoner finns det i blandningen?


