koncentration och PH
Hej!
jag har denna uppgift som jag försökt lösa den men vet inte om jag är på rätt vägen.
skulla någon kunna kolla upp det om jag tänkt rätt?
tack på förhand!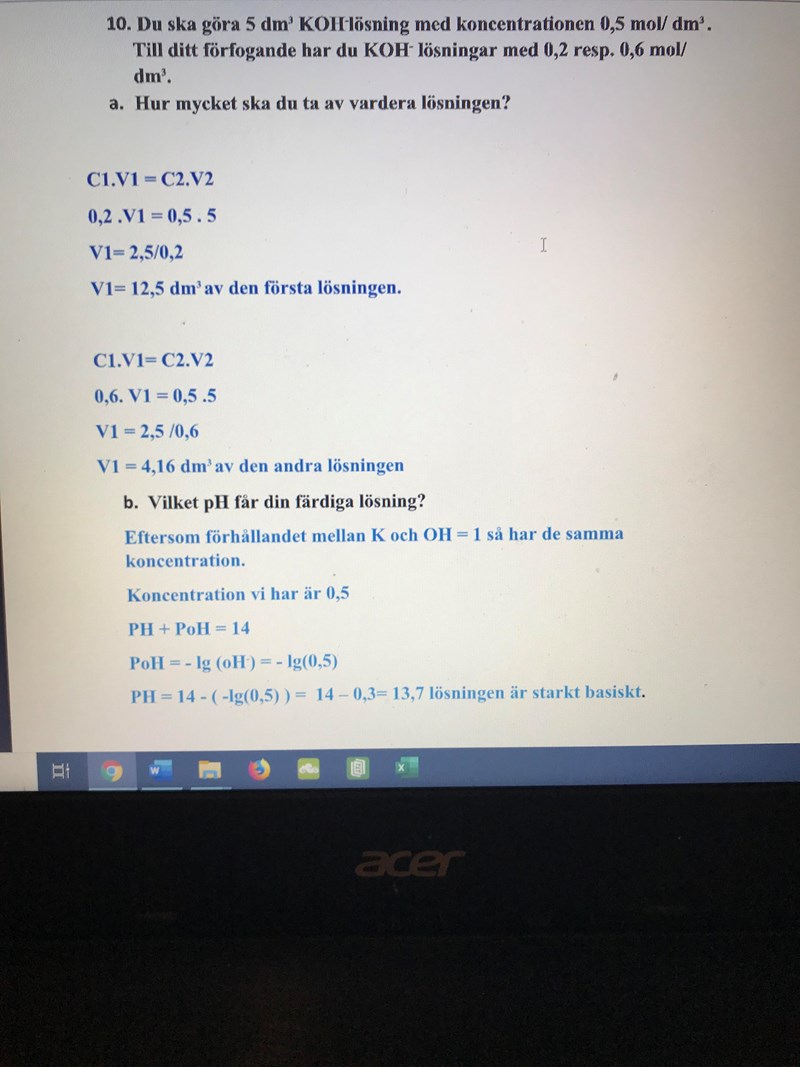
God kväll!
Nja, om jag förstått dina lösningar rätt så ska man ta 12,5 dm3 av den första lösningen och 4,16 dm3 av den andra lösningen, men då har man väl mer än 5 dm3?
Koncentrationen är korrekt, men inte volymen. I en 5 liters-lösning med koncentrationen 0.5 mol per liter får det finnas max 2.5 mol av ämnet i lösningen.
2.5 mol / 5 liter = 0.5 mol/liter.
Ekvation 1: En okänd volym av första lösningen plus en okänd volym av andra lösningen ska ge totalt 2.5 mol KOH.
0.2X + 0.6Y = 2.5 (1)
där x motsvarar antalet liter från första lösningen och y antalet liter från andra lösningen.
Ekvation 2: En okänd volym av första lösningen plus en okänd volym av andra lösningen ska ge totalt 5 liter KOH-lösning.
X + Y = 5 (2)
där x och y gäller för samma som i ekvation (1).
Ekvation (2) kan skrivas om till => X = 5 - Y
(2) i (1) ger => 0.2(5-Y) + 0.6Y = 2.5 => Y = 3.75 liter.
Tar man 3.75 liter av andra lösningen behöver man ta 1.25 liter av första lösningen för att det totalt ska bli 5 liter.
Totalt får man ut 5 liter och 2.5 mol KOH vilket ger 0.5 mol per liter.
Man behöver alltså ställa upp ett ekvationssystem för att variablerna ska kunna hänga ihop :)

