Kovalenta bindningar
Hej, mycket frågor nu, hoppas det är ok!
Vid kovalenta bildningar, så behöver det alltså inte vara så att båda atomerna måste dela med sig av elektroner till varandra? Om vi har två atomer, kan det vara så att atom 1 delar med sig av ett elektronpar till atom 2, men atom 2 delar inte med sig av några atomer till atom 1?
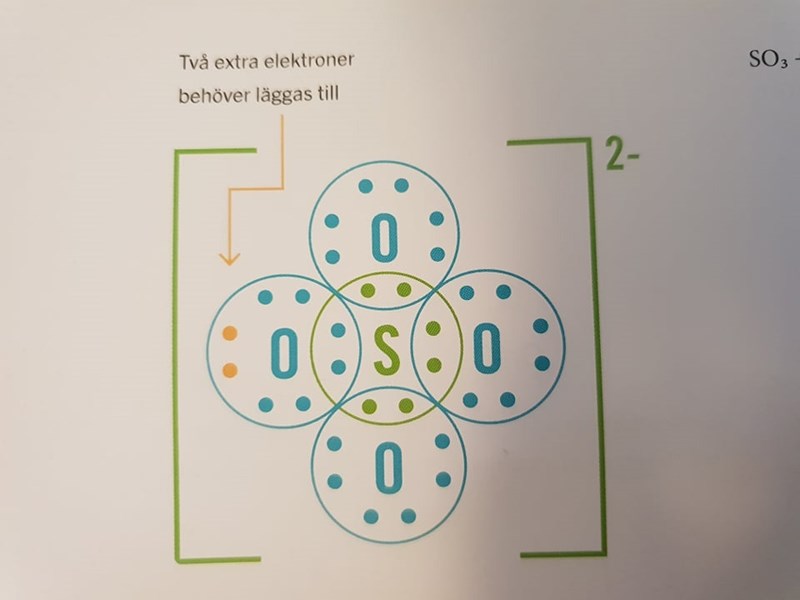
Tolkar jag nedanstående bild rätt är det så? Varje syreatom har ju 6 valenselektroner, så tre utav dom lånar ju från svavel. Men svavel har ju också 6 valenselektroner och behöver bara två till, så den lånar inte från tre utav syreatomerna? Förresten, är det dubbelbindningar eller enkelbindningar här?
Det kan vara så att den ena atomen bidrar med båda bindningselektronerna och det finns ett speciellt namn för det: dativbindning, ett slags specialfall av kovalent bindning. Det förekommer t.ex. i nitratjonen där kväveatomen behöver tre elektroner till för att nå ädelgasstruktur. Den bildar en vanlig enkelbindning till ett syre, en vanlig dubbelbindning till ett annat syre och donerar själv två elektroner till det tredje syret.
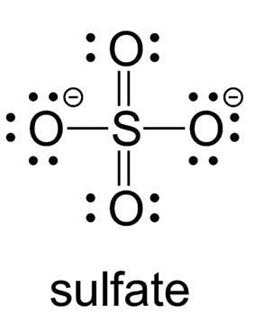
När det kommer till sulfatjonen så är situationen lite annorlunda. Det som visas på din bild är en läroboksförenkling som ger en begriplig förklaring för hur sulfatjonen ser ut, problemet är att den är felaktig. Man kan visa med experiment att åtminstone något syre skapar en dubbelbindning till svavelatomen och då håller inte den där förklaringsmodellen.
Det som egentligen sker är att svavel, till skillnad från kvävet i nitratjonen, kan ha något som kallas expanderad oktett där den omges av fler än åtta valenselektroner. Den bildar två normala enkelbindningar och två normala dubbelbindningar till de fyra syreatomerna och omges då av totalt 6+2*1+2*2=12 valenselektroner.
Nåt du kommer att märka om du fortsätter att studera kemi, speciellt om du gör det efter gymnasiet, så är det att oktettregeln och ädelgasstruktur är en grov förenkling av verkligheten. Den håller generellt sett bara för de minsta atomerna som finns i de två första perioderna, alltså inte för svavel.
Tillägg: 26 sep 2021 19:24
Jag kan tillägga att just sulfatjonen är något som man har debatterats ganska livligt och det finns en del tveksamheter kring hur den egentligen ser ut.


