Ksp, aktivitetsfaktor och jonstyrka!
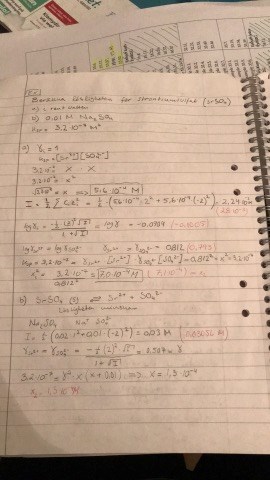
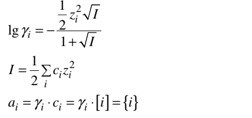
I jonstyrkeformeln, c=konc, z=laddning
Beräkna lösligheten för strontiumsulfat i vatten och i 0,01 M NaSO4.
Löslighetsprodukten 3,2*10^-7
Först räknar man ut jonstyrkan, för att sedan kunna använda formeln log(aktivitetsfaktorn), tror jag är med så långt, men sedan i uppgift b, så finns det redan SO4 i lösningen, och det är nu jag inte förstår vad som händer, jag kan förstå att eftersom det redan finns SO4 i lösningen och när Sr och SO4 ska lösa sig från SrSO4 så kommer det lösa sig mindre eftersom SO4 redan finns löst i lösningen, dvs jämvikten mellan SrSO4 och Sr + SO4 inträffar tidigare, mindre löst ämne. Varför räknar man ut jonstyrkan på lösningen NaSO4 i det fallet.
Jag bifogar uppgiften, såg dock att bilden blev lite suddig.
Skriv gärna av uppgiften och ladda upp en tydligare bild av beräkningarna, annars blir det svårt att hjälpa till.
Din bild är fullkomligt oläslig. Använd gärna formelskrivaren för att skriva läsliga formler - den finns om du skriver från en dator, det är ett rotenur-tecken som finns näst längst till höger uppe i inskrivningsrutan. /moderator
Om du löser upp x mol strontiumsulfat i 1 liter 0,01M Na2SO4 (inte NaSO4, som du har skrivit) så är koncentrationen av strontiumjoner x M och koncentrationen av sulfatjoner x+0,01 M. Sätt in koncentrationerna i uttrycket för löslighetsprodukten och beräkna x. När du vet x kan du beräkna lösligheten. Vet du vilken enhet man vill ha?
Smaragdalena skrev:Om du löser upp x mol strontiumsulfat i 1 liter 0,01M Na2SO4 (inte NaSO4, som du har skrivit) så är koncentrationen av strontiumjoner x M och koncentrationen av sulfatjoner x+0,01 M. Sätt in koncentrationerna i uttrycket för löslighetsprodukten och beräkna x. När du vet x kan du beräkna lösligheten. Vet du vilken enhet man vill ha?
Det där fungerar bara om man räknar idealt, inte reellt med Debye-Hückels lag som i det här fallet. Det lär nog bli betydande skillnader vid en så pass hög jonstyrka. Då måste man ta omvägen med aktivitetskoefficienter.
Hej och tack för respons, ja givetvis är det Na2SO4, provade formelskrivaren nu men den gjorde inte som jag ville, blev tokig så tog och la upp en bild på formler som jag använder istället.
Ja precis det går att räkna ut x ur uttrycket för ksp som du nämner, och ksp är ju givet, men det jag inte förstår är varför man räknar på jonstyrka för Na2SO4 för att sedan beräkna aktivitetsfaktorn och lösligheten.
Jonstyrkan beräknas för alla joner som finns i lösningen, inte bara de joner från saltet man löser upp.



