Kw koppling till Kb och Ka
Förstår inte riktigt vad Kw är och hur det är kopplat med Kb?
Följande samband: pH+pOH=14 vad händer om man använder den under 25 grader?
Tack i förhand!
Kw är jämviktskonstanten för vattens autoprotolys. Kan du skriva denna reaktion och ställa upp en jämviktsekvation? Vad händer om du logaritmerar bägge led?
Temperaturberoendet kan du få fram genom att reda ut huruvida reaktionen är exoterm. I så fall gynnas reaktionen åt det hållet. Hur påverkar det pH och pOH?
Om reaktionen är endoterm då? pH och pOH har ju blivit uppmått vid en speciell temperatur (25 grader). Vad händer om en lösning reagerar i en lägre temp än 25 grader?
Om reaktionen är endoterm så missgynnas den åt det hållet om temperaturen blir lägre.
Så t.ex
HCO-3 + H2O + energi ⇄ H2CO3 + OH-
är endoterm åt höger och om temperaturen är lägre kommer inte lika mycket produkter bildas? Och då blir pH annorlunda än tabellvärdet för att det inte är 25 grader? Tänker jag rätt?
Ja du tänker rätt. Därför är det alltid viktigt att ange temperaturen när man anger en jämviktskonstant.
Det är faktiskt ganska enkelt att beräkna jämviktskonstanten vid en annan temperatur om man känner till reaktionsentalpin. Då kan man använda van ’t Hoffs ekvation:
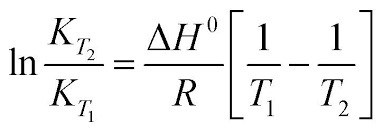
Interessant! Så för att fixa detta felet för att få tabellvärdet vid 25 grader skulle exempelvis en lösning vara att öka temperaturen på vattnet?
Om du har gjort en laboration där du har fått ett annat värde än tabellvärdet men har använt en annan temperatur så, ja. Men skillnaden blir ju större desto mer temperaturen avviker. Om du utförde experimentet vid, säg, 20 grader blir nog inte skillnaden så stor. Men du kan använda ekvationen jag postade för att själv räkna ut hur stor avvikelsen blir.
Hmm tack jag testar!
Hade en liten fundering, faktumet är att HCO3- och H2O är amfolyter. Hur kan det ha en påverkning på att Kb avviker mycket från tabellvärdet?
Vattnet är ju i kraftigt överskott, så det har väldigt liten påverkan. Att vätekarbonatjonen är en amfolyt kan däremot ha större betydelse. Konsekvensen av det är ju att en del av dessa joner reagerar och bildar karbonatjoner istället. Med andra ord blir koncentrationen av vätekarbonat lägre än den "borde vara" enligt jämvikten du kollar på. Vad innebär det för koncentrationen av hydroxidjoner?
Det går att ta hänsyn till bägge dessa jämvikter genom att ställa upp ett ekvationssystem och lösa det, men det blir ganska komplicerat och är överkurs för gymnasiet. Om du vill räkna på det kan jag visa hur man gör.
Jaha så lösningen blir mindre basisk då det finns en mindre mängd hydroxidjoner? Om detta är korrekt tänkt så skulle det förklara att det teoretiska pH-värdet blev mer basiskt.
Skulle gärna vilja se hur det räknas ut, det är aldrig för tidigt att lära sig!
Du har följande jämvikter att ta hänsyn till:
Det innebär att det finns fem ämnen med okända koncentrationer - eller fem variabler om man så vill. Vi kan kalla koncentrationer av vätekarbonatjoner för A, hydroxidjoner för B, kolsyra för C, vätejoner för D och karbonatjoner för E. För att ta reda på dessa koncentrationer behöver vi vi lika många samband, alltså fem stycken. Två stycken kan vi få från jämviktsekvationerna:
Ett tredje samband kan vi få från vattens autoprotolys:
Ett fjärde samband är ett haltvillkor där vi vet att summan av karbonatjoner, kolsyra och vätekarbonatjoner måste motsvara koncentrationen av vätekarbonatjoner man hade från början (0,1 mol/dm3 om det är samma som i din andra tråd):
Ett femte samband är ett laddningsvillkor, dvs vi vet att summan av all positiv laddning måste motsvara summan av all negativ laddning. Här får man komma ihåg att vi även har 0,1 mol/dm3 natriumjoner som bidrar till den positiva laddningen:
Nu finns det fem ekvationer där det går att ta reda på halterna för alla ämnen. Gör man det manuellt kan man göra en del antaganden och förenklingar. Använder man datorn går det snabbare:
Här får vi att:
Eftersom D är koncentrationen av vätejoner kan vi beräkna pH:
Här kan man också räkna omvänt, om vi nu återkopplar till din förra tråd. Anta att vi redan vet pH och vill beräkna pKb (här kallad F):
där får vi att
Tack! Lite komplicerat men förstår ändå metoderna.


