lång reaktion med reaktionsmekanism
Uppgift:
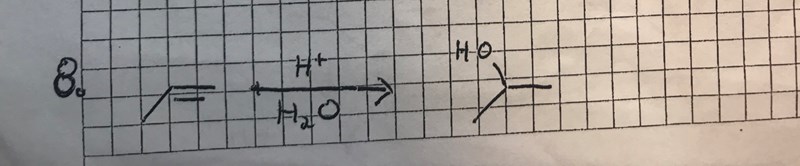
Facit:
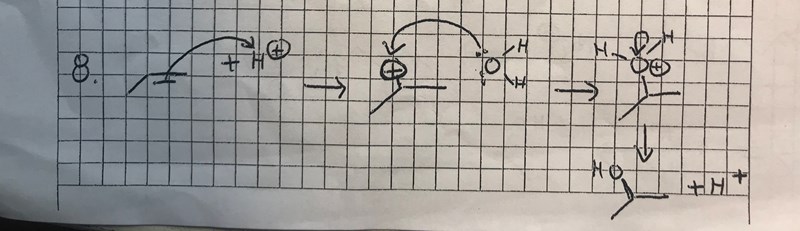
Hur ska man veta att detta sker när det står och vid reaktionspilen och vad innebär det med att dessa ämnen står vid reaktionspilen? Hur ska man även veta att reaktionen sker i så pass många steg? När man dock ritar pilarna varför går pilen till väteatomen och inte plusladdningen (när man visar att dubbelbindningen bryts)? Varför visar man inte vart vätet sätter sig och varför förflyttar sig elektronerna syre och väte delar på (i vatten) till syret och inte till vätet?
Tack på förhand
Hur ska man veta att detta sker när det står H+ och H2O vid reaktionspilen och vad innebär det med att dessa ämnen står vid reaktionspilen?
Man ser att reaktionen sker i en sur vattenlösning. Det innebär att molekylen kan tänkas reagera med vatten eller med oxoniumjoner. Ofta förkortar man oxiniumjoner till vätejoner eftersom man är lite lat.
Hur ska man även veta att reaktionen sker i så pass många steg?
Det vet man inte förrän man är färdig.
När man dock ritar pilarna varför går pilen till väteatomen och inte plusladdningen (när man visar att dubbelbindningen bryts)?
Var någonstans finns det positiva laddningar som de elektronrika dubbelbindningarna kan reagera med?
Varför visar man inte vart vätet sätter sig och varför förflyttar sig elektronerna syre och väte delar på (i vatten) till syret och inte till vätet?
Syre är mer elektronegativt än väte och därmed bättre på att dra till sig elektroner än vad vätet är på att hålla kvar dem. Att vätet "sätter sig" på en vattenmolekyl så att det bildas en oxiniumjon förväntas man känna till.
Smaragdalena skrev:Hur ska man veta att detta sker när det står H+ och H2O vid reaktionspilen och vad innebär det med att dessa ämnen står vid reaktionspilen?
Man ser att reaktionen sker i en sur vattenlösning. Det innebär att molekylen kan tänkas reagera med vatten eller med oxoniumjoner. Ofta förkortar man oxiniumjoner till vätejoner eftersom man är lite lat.
Hur ska man även veta att reaktionen sker i så pass många steg?
Det vet man inte förrän man är färdig.
När man dock ritar pilarna varför går pilen till väteatomen och inte plusladdningen (när man visar att dubbelbindningen bryts)?
Var någonstans finns det positiva laddningar som de elektronrika dubbelbindningarna kan reagera med?
Varför visar man inte vart vätet sätter sig och varför förflyttar sig elektronerna syre och väte delar på (i vatten) till syret och inte till vätet?
Syre är mer elektronegativt än väte och därmed bättre på att dra till sig elektroner än vad vätet är på att hålla kvar dem. Att vätet "sätter sig" på en vattenmolekyl så att det bildas en oxiniumjon förväntas man känna till.
Men hur vet man att man ritar så pass många steg? Alltså hur vet man när man ska gå över till ett nytt steg i reaktionen?
Plusladdningen finns hos väteatomen, men man brukar ju rita från bindningen till laddningen.
Men jag förstår inte riktigt varför det fria elektronparet drar sig till plusladdningen? Molekylen i sin helhet är ju neutral. Hur är det plusladdning där (i andra steget) trots att vätet satt sig där (borde det inte blir neutralt) eller borde snarare inte pluset vara vid kolet då det är kolet som förlorar en elektron då den måste dela den med vätet?
Tack på förhand
Men hur vet man att man ritar så pass många steg? Alltså hur vet man när man ska gå över till ett nytt steg i reaktionen?
Om det blir för rörigt att rita flera saker samtidigt, eller om man ser att "något" inte kan hända förrän "nånting annat" har hänt.
Plusladdningen finns hos väteatomen, men man brukar ju rita från bindningen till laddningen.
Elektronerna i dubbelbindningen attraheras av den positivt laddade vätejonen
Men jag förstår inte riktigt varför det fria elektronparet drar sig till plusladdningen? Molekylen i sin helhet är ju neutral. Hur är det plusladdning där (i andra steget) trots att vätet satt sig där (borde det inte blir neutralt) eller borde snarare inte pluset vara vid kolet då det är kolet som förlorar en elektron då den måste dela den med vätet?
Elektronerna i dubbelbindningen attraheras av den positivt laddade vätejonen .
Elektronerna i dubbelbindningen attraheras av den positivt laddade vätejonen
Men brukar man inte rita från bindning till laddning? Alltså fortfarande elektroner till positivt laddad vätejon men pilen ska sluta vid den positiva laddningen (pluset vid vätet)
Elektronerna i dubbelbindningen attraheras av den positivt laddade vätejonen .
Så det spelar ingen roll att molekylen är neutral i sin helhet, då den har fria elektroner. Den dras alltså fortfarande till plusladdningen.
Tack på förhand
Reaktionspilen "föreställer" hur ett elektronpar flyttar sig, det stämmer.
Smaragdalena skrev:Reaktionspilen "föreställer" hur ett elektronpar flyttar sig, det stämmer.
Men ska inte pilen från dubbelbindningen gå till det inringade pluset vid vätet? Det rätt ju där som plusladdningen elektronerna attraheras av är!
tack på förhand


