Lewisstrukturer: prioriteras oktetregeln eller minimal formell laddning?
Hej, jag gjorde denna uppgift:

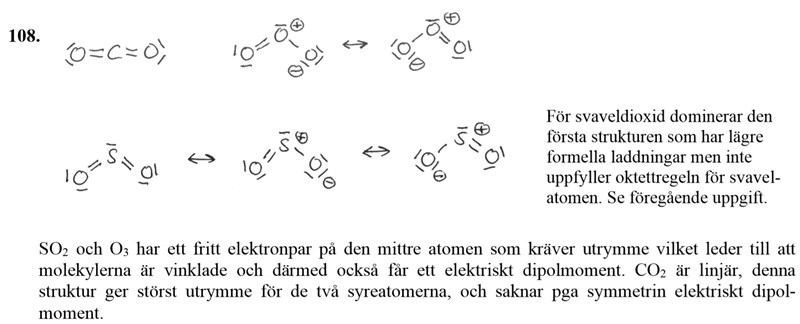
Koldioxid gjorde jag rätt, den är inte så krånglig.
Ozon gjorde jag fel, jag gissade på att det skulle vara två dubbelbindningar, syret i mitten har ett fritt elektronpar, syrerna på sidorna har två fria elektronpar var (Såhär ::O=Ö=O::). På så sätt har ju alla syreatomer noll formell laddning, är det inte bra? Två av de uppfyller oktettregeln, inte den i mitten då. I svaret uppfyller alla tre syreatomer oktettregeln, men har inte noll formell laddning.
För svaveldioxiden ritade jag bara den första som enligt facit dominerar. Hur kunde jag bara gissa mig till att de två resonansstrukturerna skulle existera? Är det för att de uppfyller oktettregeln?
Vilka orbitaler skulle de 10 elektronerna vara i, hade du tänkt? Om det hade varit en svavelatom i mitten skulle två elektroner kunna finnas i d-orbitalerna, men det finns inga d-orbitaler i syreatomen.
Ozon gjorde jag fel, jag gissade på att det skulle vara två dubbelbindningar, syret i mitten har ett fritt elektronpar, syrerna på sidorna har två fria elektronpar var (Såhär ::O=Ö=O::). På så sätt har ju alla syreatomer noll formell laddning, är det inte bra?
Jo, men är det möjligt?
Låt se:
Syret i mitten omges i din modell av 10 valenselektroner. Syrena på kanterna omges av 8 valenselektroner.
Vi kan utnyttja en av mittsyrets p-orbitaler för att skapa en sigma-bindning till ett kantsyre. En annan p-orbital för att skapa en sigma-bindning till det andra kantsyret. Vi använder en tredje p-orbital för att skapa en pi-bindning till den ena kanten och en fjärde p-orbital för att skapa en pi-bindning till andra kanten... fast... mittsyret har ju bara tre p-orbitaler, så hur ska den hitta orbitaler för att skapa alla dess bindningar? Mittsyret har visserligen två s-orbitaler också (1s och 2s), men dessa går åt för att hålla de två inre elektrorna (1s) respektive det fria elektronparet som du har ritat ut (2s). Det finns helt enkelt inte nog med orbitaler för att skapa din molekyl.
Just det det just det, det måste få plats också...




