Lite begrepp och sånt.
Hej.
Kan någon förklara på ett enkelt sätt vad följande saker betyder, tack. Jag tycker att googles förslag på svar är för komplicerade för att förstå.
Molekyl
Kovalent bindning
Det där är två begrepp som hör ihop, så vad bra att du frågade om båda samtidigt!
Du vet redan att det finns en sorts kemiska föreningar som heter jonföreningar (eller salter, det är samma sak) som uppkommer genom att positiva och negativa joner ordnar sig i ett regelbundet mönster, så att positiva joner omges av negativa joner och tvärt om, och att den sortens bindning kallas jonbindning. Jonbindning uppkommer t ex mellan en metall och en icke-metall. Metaller är bra på att ge ifrån sig elektroner (så att de blir till positiva joner) och många icke-metaller är bra på att dra till sig elektroner (och bli till negativa joner).
Om t ex klor har möjlighet att dra till sig elektroner (från t ex en metall), så blir kloratomen till en kloridjon med laddningen -1 (för då har den fått ädelgasstruktur). Om det bara finns andra icke-metaller i närheten, som "hellre" drar åt sig elektroner än lämnar dem ifrån sig, finns det en annan möjlighet - två elektroner kan dela på ett (eller flera) elektronpar. Om kvå kloratomer delar på ett elektronpar, så har båda kloratomerna 8 elektroner i sitt yttersta skal - 6 egna och två delade. Detta kallas en elektronparbindning eller en kovalent bindning. En oladdad partikel som hålls ihop av kovalenta bindningar kallas en molekyl (en laddad partikel som hålls ihop av kovalenta bindningar kallas en sammansatt jon).
Var detta svar på dina frågor? Fråga gärna mer om det behövs.
Här har du en illustration av hur molekylbindningen i en flourgasmolekyl ser ut. Molekylen består av två flouratomer som har 7 valenselektroner (elektroner i yttersta skalet) vardera. De båda vill ha 8 elektroner i sitt yttersta skal (det finns något som heter oktettlagen som säger att atomerna är som mest stabila då) och då delar de på två stycken elektroner så att båda blir nöjda och glada. Notera att atomerna inte blir lika nöjda som om de hade 8 elektroner helt för sig själva (flour bildar hellre flourjoner där de får ha alla elektroner för sig själva), men om det inte går duger det att dela på elektroner.
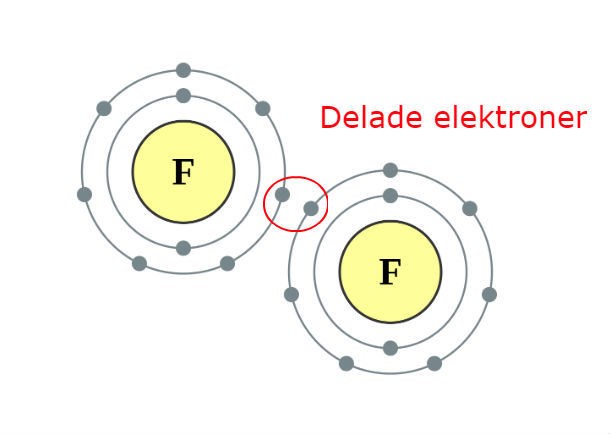
Får jag påpeka att det heter fluor? Om inte annat så för att man annars hittar artiklar om bakning om man söker på engelska efter flour.
Laguna skrev:Får jag påpeka att det heter fluor? Om inte annat så för att man annars hittar artiklar om bakning om man söker på engelska efter flour.
Jag tror det har att göra med ordet "flytande" (fast på latin) så om man tänker på formen "flutit" så har man u:et där det ska vara.
Laguna skrev:Får jag påpeka att det heter fluor? Om inte annat så för att man annars hittar artiklar om bakning om man söker på engelska efter flour.
Fasen. Det är nästan en bravad att jag lyckades stava fel varenda gång i inlägget. Mina fingrar har väl skrivit för mycket om mjöl på engelska...
Smaragdalena skrev:Det där är två begrepp som hör ihop, så vad bra att du frågade om båda samtidigt!
Du vet redan att det finns en sorts kemiska föreningar som heter jonföreningar (eller salter, det är samma sak) som uppkommer genom att positiva och negativa joner ordnar sig i ett regelbundet mönster, så att positiva joner omges av negativa joner och tvärt om, och att den sortens bindning kallas jonbindning. Jonbindning uppkommer t ex mellan en metall och en icke-metall. Metaller är bra på att ge ifrån sig elektroner (så att de blir till positiva joner) och många icke-metaller är bra på att dra till sig elektroner (och bli till negativa joner).
Om t ex klor har möjlighet att dra till sig elektroner (från t ex en metall), så blir kloratomen till en kloridjon med laddningen -1 (för då har den fått ädelgasstruktur). Om det bara finns andra icke-metaller i närheten, som "hellre" drar åt sig elektroner än lämnar dem ifrån sig, finns det en annan möjlighet - två elektroner kan dela på ett (eller flera) elektronpar. Om kvå kloratomer delar på ett elektronpar, så har båda kloratomerna 8 elektroner i sitt yttersta skal - 6 egna och två delade. Detta kallas en elektronparbindning eller en kovalent bindning. En oladdad partikel som hålls ihop av kovalenta bindningar kallas en molekyl (en laddad partikel som hålls ihop av kovalenta bindningar kallas en sammansatt jon).
Var detta svar på dina frågor? Fråga gärna mer om det behövs.
Detta hjälper väldigt mycket, tack snälla. Jag förstår mer när du förklarar så bra. -
Nu tänker jag summera lite av det du sa och förklara hur mycket jag har förstått, sedan kan du besvara det. Tack.
En jon betyder en atom som har avgett eller tagit upp en/flera valensekeltroner. Den är därmed positivt/negtativ laddad beroende på om den har ett överskott på protoner eller elektroner.
När denna överföringen av elektroner sker så sitter båda atomerna fast med avarandra eller någonting och tillsammans bildar de en jonbindning om atomerna består av minst en + och en - jon.
Sen kan jag något om någon oktektregel eller något, som betyder att hallogenerna vill uppnå ädelgasstruktur (fullständigt yttre skal, 8 elektroner alltså)
Klor drar til sig elektroner från en metall då blir atomen en kloridjon (klor atom jon version) för att den då är elektriskt laddad. Den är negativt laddad för den tog upp en elektron.
Har inte lust att läsa klart stycke 2 JUST NU(fredag) för det kräver mycket mindpower för att försöka förstå allt du säger, men jag kan säga något litet som jag kan om Kovalent bindning och så kan du kanske besvara det. :)
En kovalent bindning kan uppstå i 2 former, ren och "icke ren". Dessa typer av bindningar beror på om det är en polär bindnig eller icke polär, och om det är en polär bindning så består bindningen av olika slags atomer, alltså protonantaler är annorlunda för det är olika ämnen. Sedan motsatsen för det andra.
Vad tror du om min uppfattning? (Det jag har skrivit nu sitter i huvudet så det är ingen avskrivning) :P
Nästan rätt.
> En jon betyder en atom som har avgett eller tagit upp en/flera valensekeltroner
Det finns även fleratomiga joner.
> När denna överföringen av elektroner sker så sitter båda atomerna fast
> med avarandra eller någonting och tillsammans bildar de en jonbindning
Det är inte bara två atomer / joner, utan många joner som bildar ett regelbundet mönster (kristallgitter). Det är en avgörande skillnad jämfört med molekyler. I till exempel CO (karboniummonoxid) är det bara 2 atomer som är fast bundna till varandra.
> polär bindning så består bindningen av olika slags atomer, alltså protonantaler
Det är inte främst protonantalet som avgör, utan elektronegativiteten.
> Här har du en illustration av hur molekylbindningen i en flourgasmolekyl ser ut
Jo, det heter "fluor" (inte "flour"), med det värre problemet är planetmodellen för atomer. Sådan brukare läras ut men är rena rama felaktig. Jag tror inte att sådan hjälper till att förstå kovalent bindning. Glöm elektroner som kretsar kring atomkärnan!
Taylor skrev:
> Här har du en illustration av hur molekylbindningen i en flourgasmolekyl ser ut
Jo, det heter "fluor" (inte "flour"), med det värre problemet är planetmodellen för atomer. Sådan brukare läras ut men är rena rama felaktig. Jag tror inte att sådan hjälper till att förstå kovalent bindning. Glöm elektroner som kretsar kring atomkärnan!
Jag är inte benägen att hålla med. Det är ganska förenklad bild av hur verkligheten ser ut, ja, men den gör det mycket lättare för en nybörjare att förstå på vilket sätt elektronerna bestämmer hur ämnena reagerar. Jag skulle vilja se hur du gör en lättare förklaring men istället förklarar det med elektronens vågfunktion och elektronmoln.
Även om du ogillar modellen så används den i gymnasiekemin. Man lär sig att att elektronerna egentligen befinner sig i orbitaler runt kärnan, men det är mycket enklare att rita upp en planetmodell med skal när man ska förklara olika typer av bindningar.
Jag tycker att Bohrs atommodell fungerar hyfsat för att förklara den kovalenta bindningen i eller , men den räcker inte till för att förklara bindningen i en syrgasmolekyl (det är inte en dubbelbindning!). Oftast hoppar man över att förklara hur bindninen i är, just för att varken behöva påstå något som är fel (jag skulle tro att de flesta gymnasieelever drar en rimlig men felaktig slutsats) eller komma med en mycket krångligare förklaring (det handlar om bindande och antibindande molekylorbitaler - det är inget man behöver bry sig om på gymnasiet).
Taylor skrev:Nästan rätt.
> En jon betyder en atom som har avgett eller tagit upp en/flera valensekeltroner
Det finns även fleratomiga joner.
> När denna överföringen av elektroner sker så sitter båda atomerna fast
> med avarandra eller någonting och tillsammans bildar de en jonbindning
Det är inte bara två atomer / joner, utan många joner som bildar ett regelbundet mönster (kristallgitter). Det är en avgörande skillnad jämfört med molekyler. I till exempel CO (karboniummonoxid) är det bara 2 atomer som är fast bundna till varandra.
> polär bindning så består bindningen av olika slags atomer, alltså protonantaler
Det är inte främst protonantalet som avgör, utan elektronegativiteten.
> Här har du en illustration av hur molekylbindningen i en flourgasmolekyl ser ut
Jo, det heter "fluor" (inte "flour"), med det värre problemet är planetmodellen för atomer. Sådan brukare läras ut men är rena rama felaktig. Jag tror inte att sådan hjälper till att förstå kovalent bindning. Glöm elektroner som kretsar kring atomkärnan!
Beror helt på vilken nivå man lägger sig. Man kan använda sig av modellen och samtidigt förklara att det inte riktigt så verkligheten fungerar utan att det är en modell man använde sig av förr för att försöka förklara vissa delar, och man lyckades förklara en del saker med Bohrs atommodell.
Det går alltid att gå ett steg djupare och säga: Nej, så där är det inte. Vi vet att relativitetsteorin generaliserar klassisk mekanik, men vi lär ändå ut klassisk mekanik för det är en extremt bra approximation för tillämpningar. Vi vet att kvantmekanik inte är hela sanning för det tillåter inte materia att skapas eller annihileras, men vi lär ändå ut kvantmekanik för att det är en bra approximation för t ex väteatomen (och med numeriska metoder även svårare atomstrukturer). Sen kommer man till en kvantfältteori där alla partiklar beskrivs som störningar i olika fält som ligger över hela universum, som sedan används för att konstruera standardmodellen för partikelfysik. Men den är inte heller fullständig för den förutspår att neutriner ska vara masslösa trots att vi upptäckt att neutriner måste ha en massa (Nobelpriset 2015) och den säger ingenting om t ex mörk materia. Vi kan dessutom inte ens förklara gravitation i termer av modern fysik i dagens läge. Då är det bara vända sig mot strängteori (eller något annat) och där är vi fast.
Man måste välja en modell som ligger i nivå med det man ska lära ut och försöka förklara. Dock så tycker jag många borde bli bättre på att påminna om att en modell just är en modell, en matematisk konstruktion av oss människor att försöka beskriva någonting. Fysiken gör vad den gör vare sig vi beskriver den på det ena eller andra sättet.





.jpg?width=80&crop=0,0,80,80)
