löslighet i vatten
Behöver hjälp med en uppgift om ämnens löslighet i vatten! Den översta molekylen är karoten, färgämnet i morötter. Hur kan man se att den är mindre polär en den nedersta molekylen, betanin (färgämnet i rödbetor)? Betanin har ju en negativ syre vilket gör att den kommer ha en negativ del. Men påverkar antalet OH-gruppen i kombination med bensenringarna ämnenas polaritet? Jag tänker det kan bildas vätebindningar om dem dem fria elektronerna i bensenringen är på motsatta sida av OH gruppen. För då blir väl syret mer elektronegativt och drar till sig vätets elektroner?? Och sedan kan kanske vätet då binda sig med vattnet så det blir vätebindning och att det då blir högre löslighet? ? Om den teorin stämmer har ju ju betanin mycket fler OH grupper och bensenringar? Är detta rätt? Och vad är det som gör att karoten löser sig i vatten :(
Karoten (övre)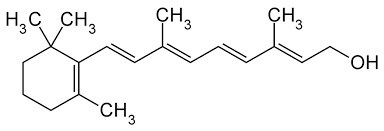
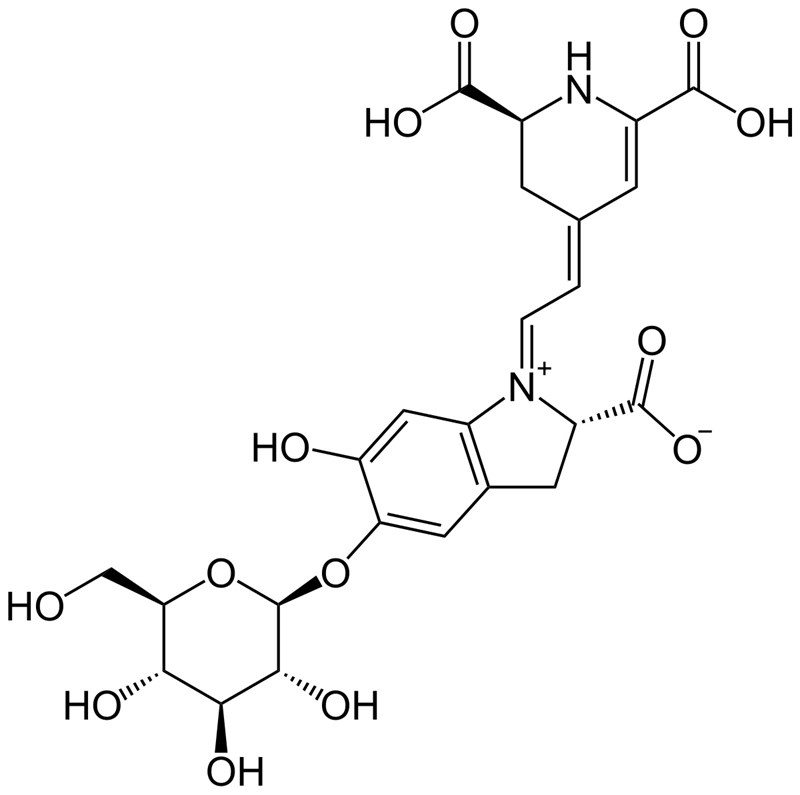 betanin(nedre)
betanin(nedre)
elsa_petersson skrev:Behöver hjälp med en uppgift om ämnens löslighet i vatten! Den översta molekylen är karoten, färgämnet i morötter. Hur kan man se att den är mindre polär en den nedersta molekylen, betanin (färgämnet i rödbetor)?
Du får jämföra hur pass polära ämnena är, det ämne med högst andel polära grupper och minst andel opolära grupper/delar, kommer lösa sig bäst i det polära vattnet.
Betanin har ju en negativ syre vilket gör att den kommer ha en negativ del. Men påverkar antalet OH-gruppen i kombination med bensenringarna ämnenas polaritet? Jag tänker det kan bildas vätebindningar om dem dem fria elektronerna i bensenringen är på motsatta sida av OH gruppen. För då blir väl syret mer elektronegativt och drar till sig vätets elektroner??
Betanin har två karboxylsyragrupper, vilka är de som jag misstänker du menar med "negativa delar". Dessa är väldigt polära, och samtliga hydroxigrupper är polära. Det finns som du ser massvis av dessa i betanin.
Några bensenringar finns det inte i något av ämnena, men det finns några omättade ringar. Dessa har dock inte några fria elektronpar som kan skapa bindningar, utan elektronerna är de av dubbelbindningar, och är då inte fria.
Elektrondragande, som du nämnde leder till att elektronerna fördelas ojämnt, det bildas dipoler. Och dipoler är, som ni nog gått igenom på kemin, en del av förklaringen till ämnens polaritet. Så de hänger ihop.
Och sedan kan kanske vätet då binda sig med vattnet så det blir vätebindning och att det då blir högre löslighet? ? Om den teorin stämmer har ju ju betanin mycket fler OH grupper och bensenringar? Är detta rätt? Och vad är det som gör att karoten löser sig i vatten :(
Karoten (övre)
betanin(nedre)
Du kan även titta på molekylernas delar och jämföra dessa. Karoten är en cyklohexen-ring tillsammans med en kolvätekedja som har endast en hydroxigrupp. Låter det som om denna vill lösa sig i vatten eller i fett?
Betanin är ett socker (längst till vänster), och två ringar, som båda har flera rejält polära grupper på sig. Låter det som om detta ämne vill lösa sig i vatten eller fett?
Betanin har två karboxylsyragrupper, vilka är de som jag misstänker du menar med "negativa delar". Dessa är väldigt polära, och samtliga hydroxigrupper är polära. Det finns som du ser massvis av dessa i betanin.
Varför är karboxylagrupper polära? Är det på grund av hydroxidgruppen? Jag förstår inte vad det är som gör den polär.
Några bensenringar finns det inte i något av ämnena, men det finns några omättade ringar. Dessa har dock inte några fria elektronpar som kan skapa bindningar, utan elektronerna är de av dubbelbindningar, och är då inte fria.
men är inte 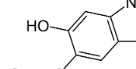 denna del i betanin en bensenring? Eller är det en av dem omättade ringarna du skrev om?
denna del i betanin en bensenring? Eller är det en av dem omättade ringarna du skrev om?
Okej så då betanin är polärt antar jag att det löser sig bra i vatten?
Och då karoten endast hade en hydroxidgrupp antar jag att den då inte kan bilda så många vätebindningar och därför löser sig sämre än betaninet?
Du kan även titta på molekylernas delar och jämföra dessa. Karoten är en cyklohexen-ring tillsammans med en kolvätekedja som har endast en hydroxigrupp. Låter det som om denna vill lösa sig i vatten eller i fett?
Också, hur påverkar kolvätekedjan poläriteten? Vi har lärt oss att ju längre kolvätekedja desto lägre poläritet, men varför är det så?
elsa_petersson skrev:Betanin har två karboxylsyragrupper, vilka är de som jag misstänker du menar med "negativa delar". Dessa är väldigt polära, och samtliga hydroxigrupper är polära. Det finns som du ser massvis av dessa i betanin.
Varför är karboxylagrupper polära? Är det på grund av hydroxidgruppen? Jag förstår inte vad det är som gör den polär.
Det är en kombination av en karbonylgrupp (C=O) och en alkohol (OH), och båda dessa består av ett mer elektronegativt syre, som båda drar till sig bindningselektronerna (till kolet). Sedan protolyseras gärna karboxylsyror, till COO-, med både elektronegativa syre, och en extra elektron, vilket gör karboxylgruppen ännu mer polär (vätekärnan har ju försvunnit, men lämnat kvar sin elektron).
Några bensenringar finns det inte i något av ämnena, men det finns några omättade ringar. Dessa har dock inte några fria elektronpar som kan skapa bindningar, utan elektronerna är de av dubbelbindningar, och är då inte fria.
men är inte
denna del i betanin en bensenring? Eller är det en av dem omättade ringarna du skrev om?
Ja precis det är en av de omättade ringarna (de har en eller flera dubbelbindningar) och den delen liknar en bensenring, men det är en del av de två ihopsatta ringarna, så denna dels egenskaper blir en summa av alla delar. Hydroxigruppen är polär, och ökar då denna rings polaritet.
Ju fler polära grupper som finns på ringen desto mer polärt blir ämnen. Men om ett ämne är polärt eller inte, beror på hela ämnets grupper och eventuella symmetri.
Okej så då betanin är polärt antar jag att det löser sig bra i vatten?
Och då karoten endast hade en hydroxidgrupp antar jag att den då inte kan bilda så många vätebindningar och därför löser sig sämre än betaninet?
Ja det stämmer, i karoten kan endast en grupp delta och skapa vätebindningar. Resten av molekylen liknar mer ett delvis omättat kolväte, med en opolär ring i ena änden och en enda polär hydroxigrupp i andra änden.
Betanin har ett socker i ena änden, socker löser sig som bekant väldigt lätt i vatten. Och resten av molekylen har flera polära grupper.
Kanske enklare att se i bilden nedan där de polära delarna är markerade i gult, och resten som inte är färgat gult är de opolära delarna av ämnena.
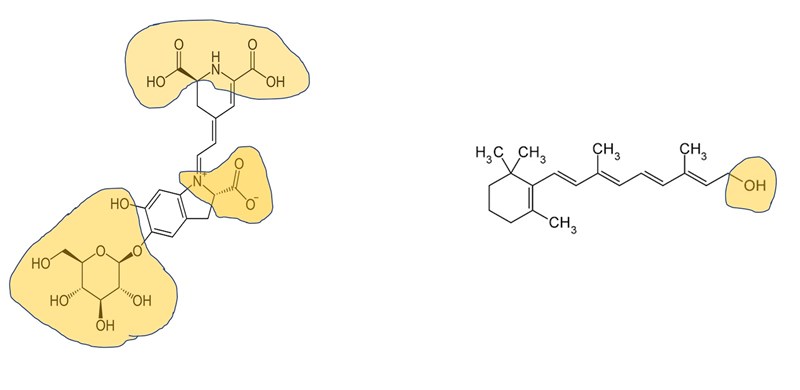
elsa_petersson skrev:Du kan även titta på molekylernas delar och jämföra dessa. Karoten är en cyklohexen-ring tillsammans med en kolvätekedja som har endast en hydroxigrupp. Låter det som om denna vill lösa sig i vatten eller i fett?
Också, hur påverkar kolvätekedjan poläriteten? Vi har lärt oss att ju längre kolvätekedja desto lägre poläritet, men varför är det så?
För att i en kolvätekedja blir det inte riktigt en dipol, då laddningsförskjutningen inte sker utan balanseras ut. Jämför med t.ex. metan som är helt symmetrisk och inte alls polär.
tack så jättemycket!! Förstår nu :DD
För all del, kul att det hjälpte!

